
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічна кінетика та хімічна рівновагаСодержание книги
Поиск на нашем сайте
Короткі теоретичні відомості Найважливішим поняттям хімічної кінетики є швидкість хімічної реакції, тобто зміна концентрації вихідних речовин або продуктів реакції за одиницю часу: V = а середня швидкість за проміжок часу Dt розраховується як V» - Швидкість хімічної реакції залежить від концентрації реагуючих речовин згідно з законом діючих мас: у кожний момент часу швидкість реакції пропорційна добутку концентрацій реагуючих речовин, які взято в степенях, рівних стехіометричним коефіцієнтам, що стоять у рівнянні хімічної реакції перед цими речовинами. Наприклад, для процесу взаємодії газоподібних речовин 2SO2 + O2 Û 2SO3; D Н < 0 (для прямої реакції) швидкості прямої та зворотної реакцій у деякий момент часу будуть дорівнювати:
де С (Хі) – концентрації речовин, k – коефіцієнт пропорційності – константа швидкості хімічної реакції, тобто швидкість при одиничних молярних концентраціях усіх речовин (1 моль/л).Потрібно вміти розраховувати зміни швидкостей реакцій при зміні концентрацій або змінах тиску й об’єму системи. Приклад 1. Як зміняться швидкості наведених вище реакцій при збільшенні тиску в два рази? Розв’язання. При збільшенні тиску в системі вдвічі концентрації всіх газів збільшаться також у два рази, що приведе до збільшення швидкостей обох реакцій:
Таким чином, швидкість прямої реакції зросте у вісім разів, а зворотної – у чотири рази. Потрібно знати, що для гетерогенних реакцій, які перебігають на поверхні твердих речовин (на відміну від гомогенних, які перебігають в усьому об’ємі), концентрації останніх незмінні і тому відсутні у виразах швидкостей, тому що кількість реагуючих частинок на одиницю площі поверхні не змінюється у ході реакції. Залежність швидкості реакції від температури можна описати простим наближеним правилом Вант-Гоффа:
де g - температурний коефіцієнт реакції, який показує, у скільки разів збільшується швидкість реакції з підвищенням температури на кожні 10°. Приклад 2. Для якоїсь реакції g =3, а зміна температури D t = 30 °С. Як зміниться при цьому швидкість реакції? Розв’язання.
Відзначимо, що швидкість реакції збільшується не внаслідок зростання кількості зіткнень, а внаслідок збільшення кількості активних молекул. У переважній більшості хімічні реакції оборотні, тобто перебігає не тільки пряма реакція (®) з утворенням продуктів, але і зворотна () – взаємодія продуктів реакції з утворенням вихідних речовин. При написанні рівнянь оборотних реакцій замість знака рівності використовують знак оборотності (Û, або Цей стан системи кількісно характеризується константою хімічної рівноваги K, або K р. Для наведеної вище реакції вираз константи рівноваги має вигляд:
де [ Хі ] - рівноважні (сталі) концентрації речовин. Отже, K дорівнює частці від ділення добутку рівноважних концентрацій продуктів реакції, взятих у степенях їх стехіометричних коефіцієнтів, на аналогічний добуток для вихідних речовин цієї ж реакції. Чим більше значення має K, тим більшою мірою відбувається прямий процес, і навпаки. K залежить тільки від природи реагуючих речовин і температури. Якщо зовнішні умови не змінюються, стан рівноваги зберігається як завгодно довго. Коли внаслідок зміни цих умов рівність швидкостей порушується, відбувається зміщення хімічної рівноваги в один із боків. Для першого прикладу в цьому розділі при підвищенні тиску в системі швидкість прямої реакції зросла у 8 разів, а зворотної – тільки у 4 рази. Це означає, що хімічна рівновага змістилась вправо, тобто в бік утворення продуктів реакції. Характер впливу зміни умов можна передбачити без будь-якого розрахунку на основі принципу Ле Шательє: зміна умов динамічної рівноваги (температури, концентрації, тиску) зумовлює переважний перебіг того з двох протилежних процесів, який протидіє цій зміні. Так, підвищення тиску зумовлює переважний перебіг процесу, внаслідок якого знижується тиск газу. Останній пропорційний кількості молів газоподібних речовин, тому в наведеному прикладі рівновага зміщується вправо, що відповідає розрахункам. Але зміна тиску не впливає на стан рівноваги реакцій, у ході яких не змінюється кількість молів газів. При підвищенні температури переважно відбувається процес, який сприяє охолодженню системи, тобто рівновага зміщується у бік ендотермічної реакції, і навпаки. У нашому випадку пряма реакція є екзотермічною, тому підвищення температури буде зміщати рівновагу вліво, тобто у бік зворотної реакції.
Задачі 1. Для реакції 4HCl + O2 Û 2Cl2 + 2H2O, що перебігає у газовій фазі, запишіть вирази для швидкостей прямої та зворотної реакцій, константи хімічної рівноваги. Як зміниться швидкість прямої реакції при збільшенні втричі: а) концентрації кисню; б) концентрації хлориду гідрогену; в) загального тиску? 2. Розкладання N2O на поверхні золота при високих температурах відбувається за рівнянням: 2N2O Û 2N2 + О2. Константа швидкості цієї реакції дорівнює 5×10-4 л×моль-1× хв-1 при 1173 К. Початкова концентрація N2O дорівнює 3,2 моль/л. Визначте швидкість реакції при заданій температурі у початковий момент і в той момент, коли розкладеться 25 % N2O. Який стан називається хімічною рівновагою? В який бік зміститься рівновага у цій системі при збільшенні тиску? 3. Чому швидкість хімічної реакції збільшується при підвищенні температури? Що називають температурним коефіцієнтом швидкості реакції? Як зміниться швидкість хімічної реакції при зміні температури: а) від 60 до 100°С; б) від 150 до 100°С? Температурний коефіцієнт швидкості реакції дорівнює двом. 4. Для реакції 4HCl(г.) + O2(г.) Û 2Cl2(г.) + 2H2O(рід.) запишіть вираз для швидкостей прямої та зворотної реакцій відповідно закону діючих мас. Що називають константою швидкості хімічної реакції? Який її фізичний зміст? Від яких факторів залежить її значення? Розрахуйте, як зміняться швидкості обох реакцій при збільшенні загального тиску реакційної суміші у два рази? 5. Що називають хімічною рівновагою? Чому вона динамічна? Запишіть вирази константи хімічної рівноваги для таких хімічних реакцій: Н2(г.) + Cl2(г.) Û 2HCl(г.), D Н < 0; 2H2O(г.) Û 2Н2(г.) + О2(г.), D Н > 0. Від яких факторів залежить величина константи хімічної рівноваги? В якому напрямі зміститься рівновага для кожної реакції при: а) збільшенні загального тиску; б) нагріванні; в) збільшенні концентрації вихідних речовин? 6. Для реакції синтезу аміаку N2(г.) + 3Н2(г.) Û 2NH3(г.) розрахуйте, у скільки разів треба підвищити: а) концентрацію; б) тиск; щоб швидкість прямої реакції збільшилася: а) у 16 і б) у 256 разів? Як зміниться швидкість цієї реакції при збільшенні тиску в 10 разів? 7. Для реакції 2SO2(г.) + O2(г.) Û 2SO3(г.) запишіть вирази для швидкостей прямої та зворотної реакцій, константи хімічної рівноваги. Як треба змінити тиск газової суміші для того, щоб збільшити швидкість прямої реакції в 27 разів? Як зміниться при цьому швидкість зворотної реакції? В якому напрямі зміститься хімічна рівновага? 8. Рівновага у реакції 2SO2(г.) + O2(г.) Û 2SO3(г.) встановилася при концентраціях SO2, O2 і SO3, що дорівнюють 0,1; 0,05 та 0,9 моль/л відповідно. Як зміняться швидкості прямої та зворотної реакцій при збільшенні тиску газової суміші вдвічі? Чи зміститься рівновага? Відповідь дайте на підставі розрахунків. 9. Як зміняться швидкості прямої та зворотної реакцій А2(г.) + 2В2(г.) Û 2АВ2(г.), якщо загальний тиск газової суміші збільшити у 2 рази і водночас підвищити температуру на 20 градусів? Температурні коефіцієнти швидкостей прямої та зворотної реакцій дорівнюють, відповідно, 2 і 3. Екзо- чи ендотермічною є пряма реакція? Чи зміститься рівновага у системі? Якщо так, то в якому напрямі? 10. Хімічна реакція перебігає за рівнянням 2NO(г.) + O2(г.) Û 2NO2(г.). Початкові концентрації реагуючих речовин дорівнюють, моль/л: С (NO) = 0,8; С (O2) = 0,6. Як зміниться швидкість реакції, якщо концентрацію кисню збільшити до 0,9 моль/л, а концентрацію оксиду нітрогену - до 1,2 моль/л? Запишіть у загальному вигляді вираз константи хімічної рівноваги цієї реакції. Від яких факторів залежить її значення? 11. Чому підвищення температури збільшує швидкість хімічної реакції? Які молекули називають активними? Користуючись правилом Вант-Гоффа, визначте величину температурного коефіцієнта реакції розкладання мурашиної кислоти на СО2 і Н2 при наявності золотого каталізатора, якщо константа швидкості цієї реакції при 413 К дорівнює 5,5 × 10-4 с-1, а при 458 К - 9,2 × 10-3 с-1. 12. Наведіть засоби, за допомогою яких можна збільшити або зменшити швидкість реакції: 2H2S(г.) + 3O2(г.) Û SO2(г.) + 2H2O(г.), D Н < 0. Розрахуйте, як зміняться швидкості прямої та зворотної реакцій при: а) збільшенні парціального тиску H2S вдвічі; б) зменшенні загального об’єму системи вдвічі; в) збільшенні температури на 20°С (gпрямої = 2; gзворотної = 3). В якому напрямі зміститься стан хімічної рівноваги у кожному разі? 13. Чому у вирази для швидкості хімічної реакції або константи хімічної рівноваги не входять концентрації речовин, які знаходяться у твердій фазі? Для реакцій СаО(тв.) + 3С(тв.) Û СаС2(тв.) + СО(г.); SO3(г.) + С(тв.) Û SO2(г.) + СО(г.) наведіть вирази для швидкостей прямої та зворотної реакцій, констант хімічної рівноваги. В яких напрямах зміститься рівновага у цих системах при: а) збільшенні тиску; б) збільшенні парціального тиску СО? 14. Якщо для двох реакцій однакові концентрації реагуючих речовин і температура, то чим тоді визначається відмінність їх швидкостей? Наведіть вирази для швидкостей прямої та зворотної реакцій, що перебігають у системах: 2NO(г.) + O2(г.) Û 2NO2(г.), D Н < 0; 2N2(г.) + O2(г.) Û 2NO(г.), D Н > 0. В яких напрямах зміститься рівновага в обох системах при: а) збільшенні тиску; б) нагріванні? 15. У закритій ємності при сталій температурі перебігає реакція: СО(г.) + Сl2(г.) Û СОСl2(г.). Для реакції було взято по 1 моль вихідних речовин. У рівноважній суміші знайдено 0,5 моль СО. Як змінився тиск у результаті реакції порівняно з вихідним? Розрахуйте значення константи хімічної рівноваги. 16. Охарактеризуйте стан хімічної рівноваги. Як змінюються швидкості прямої та зворотної реакцій з початку перетворення і до моменту досягнення рівноваги? Чи перебігають пряма та зворотна реакції після встановлення рівноваги? Наведіть вирази констант хімічної рівноваги для реакцій: С(тв.) + Н2О(г.) Û СО(г.) + Н2(г.), D Н 0 = 117,2 кДж; 2СО(г.) + О2(г.) Û 2СО2(г.), D Н 0 = -569,4 кДж У яких напрямах відбудеться зміщення хімічної рівноваги при: а) охолодженні; б) збільшенні загального тиску? 17. Рівновага у системі 2NO2(г.) Û 2NO(г.) + O2(г.) при деякій температурі встановилася при концентраціях (моль/л): С(NO2) = 0,06; С(NO) = 0,24; С(O2) = 0,12. Розрахуйте значення константи хімічної рівноваги і вихідну концентрацію NO2. В яких напрямах зміститься хімічна рівновага при: а) збільшенні концентрації NO2; б) збільшенні тиску газової суміші? 18. Для реакції 4Fe(тв.) + 3О2(г.) Û 2Fe2О3(тв.) запишіть вирази для швидкостей прямої та зворотної реакцій, константи хімічної рівноваги. Які умови (тиск, концентрація, температура) і чому сприяють перебігу реакції в бік розкладання оксиду? 19. Метанол утворюється внаслідок реакції: СО(г.) + 2Н2(г.) Û СН3ОН(тв.); D Н 0 = -127,8 кДж. Запишіть вирази для швидкостей прямої і зворотної реакцій, константи хімічної рівноваги. В якому напрямі зміститься рівновага при: а) підвищенні температури; б) підвищенні загального тиску; в) підвищенні парціального тиску СО? 20. Якщо об’єм кожної газової суміші зменшити у три рази, то як зміняться швидкості прямої та зворотної реакцій у системах: Н2(г.) + Cl2(г.) Û 2HCl(г.); 2SO2(г.) + O2(г.) Û 2SO3(г.). Як це вплине на рівновагу в кожній системі? Запишіть вирази для констант хімічної рівноваги у кожному разі. 21. Для системи реагуючих речовин 2NO(г.) + O2(г.) Û 2NO2(г.) запишіть вирази для швидкостей прямої та зворотної хімічних реакцій, константи хімічної рівноваги. Як зміниться швидкість прямої реакції при: а) одночасному збільшенні концентрації NO у два рази і концентрації O2 - у три рази; б) збільшенні загального об’єму в два рази? В яких напрямах зміститься хімічна рівновага у кожному випадку? 22. Що таке константа швидкості хімічної реакції і який її фізичний зміст? Від чого залежить константа швидкості? Чи може вона змінюватися у ході реакції? Для оборотних процесів 2N2O5(г.) Û 2N2O4(г.) + O2(г.); 8NH3(г.) + 3Br2(г.) Û 6NH4Br(тв.) + N2(г.) запишіть вирази для швидкостей прямої та зворотної реакцій, констант хімічної рівноваги. Як зміниться швидкість прямої та зворотної реакцій для першого процесу при збільшенні об’єму реакційної ємності у два рази? В якому напрямі зміститься хімічна рівновага? 23. Поясніть, чому числове значення константи хімічної рівноваги визначає глибину перетворення вихідних речовин у продукти? Від яких факторів залежить константа хімічної рівноваги? Запишіть вирази констант рівноваги для таких оборотних процесів: 4НBr(г.) + О2(г.) Û 2Br2(рід.) + 2Н2О(рід.), D Н 0 < 0; Al2(SO4)3(тв.) Û Al2O3(тв.) + 3SO3(г.), D Н 0 > 0. В яких напрямах буде зміщуватися хімічна рівновага в обох випадках при: а) зменшенні температури, б) збільшенні тиску? 24. При деякій температурі константа хімічної рівноваги термічної дисоціації N2O4 Û 2NO2 дорівнює 0,26. Рівноважна концентрація NO2 дорівнює 0,28 моль/л. Обчисліть рівноважну та початкову концентрації N2O4. Яка масова частка (у %) цієї речовини продисоціювала до моменту встановлення рівноваги? 25. Для оборотних процесів СОСl2(г.) Û СО(г.) + Сl2(г.), D Н 0 = 112,5 кДж; ZnO(тв.) + SO3(г.) Û ZnSO4(тв.), D Н 0 = - 236 кДж запишіть вирази для швидкостей прямої та зворотної реакцій, константи хімічної рівноваги. В яких напрямах буде зміщуватися рівновага в обох реакціях при: а) збільшенні температури; б) збільшенні тиску газів?
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 345; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.192.89 (0.007 с.) |

 ,
, = +
= +  .
. =
=  (С (SO2))2 С (O2);
(С (SO2))2 С (O2); =
= 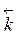 (С (SO3))2,
(С (SO3))2, =
=  (2 С (SO2))2×(2 С (O2)),
(2 С (SO2))2×(2 С (O2)),  /
/  = 8;
= 8; =
=  (2 С (SO3))2,
(2 С (SO3))2,  = g
= g 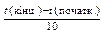 ,
, ×
× ). Швидкість прямої реакції з часом зменшується, тому що зменшуються концентрації вихідних речовин; а зворотної – збільшується, тому що збільшуються концентрації продуктів. Нарешті швидкості обох реакцій зрівнюються і система переходить у стан хімічної рівноваги. Після цього кількісні зміни у системі зникають: зменшення концентрацій вихідних речовин і збільшення концентрацій продуктів реакції більше не відбувається.
). Швидкість прямої реакції з часом зменшується, тому що зменшуються концентрації вихідних речовин; а зворотної – збільшується, тому що збільшуються концентрації продуктів. Нарешті швидкості обох реакцій зрівнюються і система переходить у стан хімічної рівноваги. Після цього кількісні зміни у системі зникають: зменшення концентрацій вихідних речовин і збільшення концентрацій продуктів реакції більше не відбувається. ,
,


