
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Номери розділів для виконання Д/з: 1,2,3,4,5Содержание книги
Поиск на нашем сайте
Номери розділів для виконання Д/з: 1,2,3,4,5 ЗМІСТ
ВСТУП
Хімія – це наука, що вивчає будову та властивості речовин, а також закономірності їх взаємодії та взаємних перетворень. Вона має величезне значення для розуміння сутності різних явищ природи, біохімічних процесів у живих організмах, їх взаємозв’язку і взаємозумовленості. І живі організми, і т. з. нежива природа складаються з одних і тих самих елементів, однак на групу органогенних елементів (Гідроген, Оксиген, Карбон, Нітроген, Сульфур і Фосфор) припадає 99,7 %, а на решту – лише 0,3 %. Пізнаючи природні явища, людина прагне керувати ними, відкривати і створювати нові речовини з наперед заданими властивостями. Щорічно у світі синтезується понад 250 невідомих раніше хімічних сполук. Серед них більшість корисних, але є шкідливі, токсичні й навіть дуже небезпечні речовини. Ось чому потрібно вивчати будову атомів і молекул, їх властивості, а також закономірності перебігу хімічних і біохімічних реакцій. Хімічні дослідження дозволяють передбачити напрямок процесів, розрахувати супровідні їм теплові ефекти, виявити можливості збільшення виходу корисного і, головне, нешкідливого для природи та здоров’я людини продукту. До найактуальніших проблем сьогодення відносять профілактику та боротьбу із забрудненням довкілля, розробку екологічно чистих технологій, утилізацію відходів і побічних продуктів промислових підприємств. Хімічна індустрія тісно пов’язана з іншими галузями промисловості та сільського господарства, тому підвищення рівня хімічної освіти інженерів ефективно сприяє вирішенню екологічних проблем майже в усіх промислових регіонах країни.
І. ПРОГРАМА КУРСУ
Тема 1. Основні поняття хімії Хімія як розділ природознавства та її роль у формуванні світогляду інженерів. Хімія та охорона навколишнього середовища. Предмет хімії. Поняття про матерію та рух. Форми існування матерії: речовина і поле. Хімічний елемент. Атом. Молекула. Проста речовина та хімічна сполука. Фізичні та хімічні явища, їх взаємозв’язок. Класифікація хімічних реакцій. Стехіометричні закони: закон збереження маси речовин, закон сталості складу, закон Авогадро. Відносна атомна та молекулярна маси. Кількість речовини. Моль. Стала Авогадро. Молярна маса речовини. Молярний об’єм газу. Відносна густина одного газу за іншим. Визначення молекулярних мас речовин, що перебувають у газоподібному стані. Тема 2. Будова атомів. Періодичний закон і періодична система Д.І. Менделєєва
Поняття про двоїсту корпускулярно-хвильову природу електронів. Квантово-механічна модель атома: квантові числа, атомні орбіталі. Принципи розподілення електронів по атомних орбіталях: принцип найменшої енергії (правила Клечковського), принцип Паулі, правило Гунда. Електронні формули атомів елементів; s -, p -, d -, f -елементи. Періодичнийзакон Д.І. Менделєєва. Структура періодичної системи та періодичність зміни властивостей елементів з точки зору електронної будови атомів. Валентність елементів у нормальному та збудженому станах. Енергія іонізації та спорідненість до електрона як характеристики металічних і неметалічних властивостей елементів. Визначення хімічних властивостей елементів згідно з їх положенням у періодичній системі. Значення періодичного закону.
Тема 3. Хімічний зв’язок і будова молекул. Твердий стан речовин
Природа хімічного зв’язку. Енергія та довжина зв’язку. Типи хімічного зв’язку. Електронегативність. Ковалентний зв’язок та його властивості: насиченість, напрямленість, полярність. Ефективний заряд атомів. Механізми утворення ковалентного зв’язку. Способи перекривання атомних орбіталей:s- та p-зв’язки. Кратний зв’язок. Гібридизація атомних орбіталей. Іонний зв’язок та його властивості. Просторова будова молекул. Валентні кути. Типи ковалентних молекул: полярні та неполярні молекули. Електричні моменти диполів молекул. Міжмолекулярна взаємодія: орієнтаційна, індукційна, дисперсійна. Водневий зв’язок. Енергія міжмолекулярної взаємодії. Типи кристалічних решіток. Поняття про металічний зв’язок. Залежність фізичних властивостей речовини у кристалічному стані від характеру зв’язку між частинками кристалічної решітки. Тема 4. Елементи хімічної термодинаміки
Предмет хімічної термодинаміки. Поняття ентальпії. Тепловий ефект реакції. Термохімія. Особливості термохімічних рівнянь реакцій. Стандартна ентальпія утворення простих речовин і хімічних сполук. Закон Гесса та наслідки з нього. Термохімічні розрахунки. Поняття ентропії. Другий та третій закони термодинаміки. Стандартна ентропія. Зміна ентропії при фазових перетвореннях і під час хімічних реакцій. Енергія Гіббса. Стандартна енергія Гіббса утворення простих речовин і хімічних сполук. Зміна енергії Гіббса при хімічних реакціях. Термодинамічна умова можливості довільного перебігу реакції. Вплив температури на напрямок перебігу реакції. Тема 5. Хімічна кінетика та хімічна рівновага
Гомогенні та гетерогенні реакції. Залежність швидкості реакції від концентрації реагуючих речовин, закон діючих мас. Константа швидкості реакції, її фізичний зміст. Швидкість гетерогенних реакцій. Енергія активації. Вплив температури на швидкість реакцій. Правило Вант-Гоффа. Ланцюгові реакції. Каталіз. Оборотні реакції. Хімічна рівновага. Константа рівноваги, її зв’язок з енергією Гіббса. Вплив зовнішніх факторів на хімічну рівновагу. Принцип Ле Шательє.
Тема 6. Загальні властивості розчинів. Розчини електролітів Загальна характеристика розчинів. Способи вираження концентрації розчину, їх взаємозв’язок. Електролітична дисоціація, її причини. Ступінь дисоціації, залежність його від концентрації електролітута температури. Сильні та слабкі електроліти. Константа дисоціації слабких електролітів. Закон розведення Оствальда. Класифікація електролітів за характером іонів, що утворюються при дисоціації: кислоти, основи, амфотерні гідроксиди, солі. Дисоціація води. Водневий показник. Реакції обміну в розчинах електролітів, умови їх перебігу. Правила складання іонно-молекулярних рівнянь реакцій. Тема 9. Хімічні властивості металів
Електронна будова атомів металів. Відновні властивості металів. Взаємодія металів із водою, розчинами лугів і кислотами. Оксиди та гідроксиди металів, їх хімічний характер. Застосування металів у техніці та промисловості.
ІІ. КОНТРОЛЬНІ ЗАДАЧІ Загальні вказівки Навчально-методичний посібник призначено для студентів заочної форми Міжрегіонального Інституту Підвищення Освіти (МІПО) НТУУ “КПІ”. Їх метою є надання допомоги студентам при самостійній роботі над курсом хімії. Для засвоєння курсу хімії студент повинен використовувати навчальну літературу та керуватися програмою, наведеною у навчально-методичному посібнику. Вивченню навчального матеріалу допоможе стисле викладення окремих розділів курсу та приклади розв’язання типових задач. За матеріалом програми курсу студенти складають іспит. До іспиту допускаються студенти, які виконаливсі лабораторні роботи, своєчасно підготували контрольне завдання та захистили його під час співбесіди з викладачем. Розв’язання задач контрольних завдань слід оформити в окремому зошиті. Для зауважень рецензента потрібно залишити поля. При надісланні контрольного завдання студент має вказати прізвище, ім’я, по батькові, адресу, номер варіанта, дату виконання, а також підписати завдання. Варіант контрольного завдання вказує викладач. Контрольне завдання, що виконане не за своїм варіантом, викладач не рецензує. Номери та умови задач слід розташовувати у послідовності, що відповідає їх переліку в завданні. Завдання складається з 12 задач і запитань. Умови задач необхідно переписувати. Для розв’язання задач слід використовувати дані з таблиць, які наведені у додатку. Розв’язки та відповіді на запитання мають бути стислими, але обґрунтованими. Необхідно наводити всі математичні розрахунки. Запис формул і рівнянь реакцій обов’язковий. Для перших 25-ти варіантів номер задач за кожним розділом співпадає з номером варіанту. Наприклад: якщо варіант 1, то потрібно розв’язувати задачі за номером 1 у кожному розділі; якщо варіант 7, всі задачі за номером 7 тощо. Розподіл задач для варіантів 26 – 75 наведено у таблиці на стор. 9.
ОСНОВНІ ПОНЯТТЯ ХІМІЇ Короткі теоретичні відомості Атоми та молекули мають дуже малі абсолютні маси, які неможливо вимірити ніякими технічними пристроями. Тому в хімії та фізиці використовують так звані відносні атомні та молекулярні маси - Аr (Х) і Мr (Х) відповідно (Х – хімічна формула речовини). За одиницю вимірювання при цьому береться маса 1/12 атома Карбону (ізотопу С12). Отже, відносна атомна або молекулярна маса показує, у скільки разів абсолютна маса даної частинки m 0 більша за масу 1/12 атома Карбону: Ar (X) або Mr (X) = Наприклад, Ar (С) = 12, Ar (О) = 16, Ar (Н) = 1 тощо. Відносні атомні та молекулярні маси розмірності не мають. Відносна молекулярна маса дорівнює сумі відносних атомних мас елементів з урахуванням кількості атомів цих елементів у молекулі, наприклад: Mr (О2) = 2 × 16 = 32; Mr (СО) = 12 + 16 = 28; Mr (СО2) = 12 + 2 × 16 = 44; Mr (CH4) = 12 + 4 × 1 = 16. Речовина вимірюється її кількістю. Під кількістю речовинирозуміють певне число окремих частинок цієї речовини (атомів, молекул, іонів тощо) - N, або N (X). Але так робити кількісні розрахунки незручно, тому введено спеціальну одиницю кількості - 1 моль, який містить так зване число Авогадро частинок - NА» 6,02 × 1023 моль-1. Абсолютна маса числа Авогадро (тобто одного моля) атомів Карбону дорівнює 12 грамам. Тоді маси одного моля атомів Оксигену, молекул O2, СО, СО2 і CH4 дорівнюють 16, 32, 28, 44 і 16 грамам відповідно. Маса одного моля речовини називається молярною масою. Вона позначається літерою М, або М (Х), і має розмірність г /моль. Чисельно молярна маса дорівнює відносній молекулярній масі. Кількість молів (або просто кількість) речовини позначають n, або n (X). Для певної маси будь-якої речовини m (X) кількість речовини дорівнює: n (x) = а абсолютна маса однієї молекули цієї речовини m 0(Х) = Наприклад, для Карбону m 0(С) = 12/(6,02 × 1023)» 1,99 × 10-23 г. При розв’язанні типових задач за цією темою потрібно знати універсальний закон, що діє для газів – закон Авогадро: у рівних об’ємах різних газів, взятих за однакових умов (тиск р і температура Т), міститься однакова кількість молекул. Наслідки з цього закону: 1. 1 моль будь-якого газу за нормальних умов (р = 1,013 × 105 Па; Т = 273 К) займає об’єм 22,4 літри. Цей об’єм називають молярним об’ємом газу. Він позначається VМ, або VМ (Х), і має розмірність л/моль. Кількість газоподібної речовини через молярний об’єм дорівнює: n (x) = 2. Відносна густина одного газу (Х) за іншим (Y), DY (X), - це відношення мас рівних об’ємів цих газів, взятих за однакових умов, або відношення їх молярних мас: DY (X) = Приклад 1. Маса 5,6 л (н. у.) деякого газу дорівнює 10 г. Обчисліть для цього газу молярну та відносну молекулярну маси, масу однієї молекули у грамах, кількість речовини та кількість молекул у цьому об’ємі. Розв’язання. Складаємо пропорцію та знаходимо кількість молів газу: VМ - 1 моль V - х, звідки х = n = Знаючи кількість речовини, розраховуємо молярну масу: М = Відносна молекулярна маса газу чисельно дорівнює молярній масі: Мr = 40. Абсолютна маса однієї молекули: m 0 = Кількість молекул: N = nNA = 0,25 × 6,02 × 1023 = 1,505 × 1023. При розв’язанні багатьох задач треба вміти робити розрахунки згідно з рівняннями хімічних реакцій. При цьому необхідно знати, що коефіцієнти перед формулами речовин у рівнянні (т. з. стехіометричні коефіцієнти) дають кількісні (мольні) співвідношення реагентів і продуктів реакції. Наприклад, у реакції 2Al + 6HCl = 2AlCl3 + 3H2 на кожні 2 моль Al витрачається 6 моль HCl. При цьому утворюється 2 моль AlCl3 і 3 моль H2. Приклад 2. Для наведеної вище реакції розрахувати масу хлориду алюмінію AlCl3 і об’єм водню Н2 (н. у.), якщо у реакції беруть участь 5,4 г алюмінію. Розв’язання. Ar (Al) = 27, Mr (AlCl3) = 106,5. Згідно з рівнянням реакції 1 моль (тобто 27 г) Al відповідає 1 моль (або 133,5 г) AlCl3. Тому складаємо пропорцію: 27 г Al - 133,5 г AlCl3 5,4 г - х, звідки х = m (AlCl3) = Також діємо при розрахунку об’єму водню: 2 × 27 г Al - 3 × 22,4 л H2 5,4 г - у, звідки у = V (H2) = Задачі 1. Маса молекули деякої речовини становить 1,2×10-25 к г. Чому дорівнюють відносна молекулярна та молярна маси цієї речовини? Яку кількість містить 1 к г цієї речовини? 2. Маса 1×10-3 м3 газу (н.у.) дорівнює 1,175×10-3 к г. Розрахуйте молекулярну масу газу і масу однієї його молекули. Яке число молекул газу знаходиться у даному об’ємі? 3. Чому дорівнюють молекулярна, молярна маси та маса однієї молекули СО2? Який об’єм СО2 (н.у.) утвориться при згорянні 1,2×10-2 к г вуглецю? Яке число молекул цього газу буде знаходитись у цьому об’ємі? 4. Порівняйте число молекул, які містяться у 4 к г кожного з газів: СО2 і NO2. Визначте кількості цих речовин і об’єми, що займають гази за н.у. 5. Маса 8,7×10-5 м3 газу при 62 °С і тиску 1,01×105 Па дорівнює 2,4×10-4 к г. Розрахуйте молекулярну масу речовини і масу однієї його молекули. 6. Які об’єм і маса оксиду нітрогену (II) утворюються при взаємодії 5×1020 молекул азоту з киснем? Чому дорівнюють молекулярна і молярна маси, маса однієї молекули NO? 7. Яка кількість речовини і скільки молекул містяться: а) 0,1 м3 водню (н.у.); б) 0,1 к г водню? Чому дорівнює маса однієї молекули Н2? 8. В якій масі СО2 міститься стільки ж молекул, скільки їх у 2,8×10-3 к г СО? Які кількості речовин містяться у цих масах? 9. При розпіканні СаСО3 масою 1 к г одержані СаО масою 0,56 к г і СО2 об’ємом 0,224 м3 (н.у.). Чи підтверджують ці дані закон збереження маси речовин? Визначте число молекул і кількість речовини СО2 у наведеному об’ємі? 10.Чому дорівнюють молярна маса та маса однієї молекули метану (СН4)? Складіть рівняння реакції горіння метану на повітрі і розрахуйте об’єм і масу цього газу, якщо на його згоряння витрачено 112 л кисню. 11.Визначте масову частку домішок (%) у технічному цинку, якщо його наважка масою 20,4 г витісняє з соляної кислоти, взятої у надлишку, водень об’ємом 6,272 л (н.у.)? Яку кількість речовини становить указаний об’єм водню? Скільки молекул газу містяться у ньому? 12.Змішано рівні за масою (10 г) кількості газів: водню Н2, метану СН4 і азоту N2. Розрахуйте об’єм (н.у.) газової суміші, масу одного її літру (н.у.), загальне число молекул усіх газів у 1 л суміші. 13.Для газоподібних азоту N2 і оксиду карбону (II) CО визначити: а) співвідношення об’ємів рівних мас цих газів; б) маси 1 л газів; в) молярні маси і маси однієї молекули кожного з цих газів. 14. Маси 1 л наведених газів дорівнюють: а) ацетиленy - 1,17 г; б) гелію - 0,17 г; в) етану - 1,36 г. Визначте молекулярні, молярні маси і маси однієї молекули кожного газу. Використовуючи величину відносної густини одного газу за іншим, визначте, який газ важчий, а який - легший за повітря? 15.У три склянки з водою опущено по 1 граму металів: у першу - натрію, у другу - калію, у третю - кальцію. В якому випадку виділиться найбільша кількість водню? Розрахуйте кількість, масу та об’єм водню у цій реакції. Чому дорівнює маса однієї молекули Н2? 16.Розрахуйте об’ємну частку оксиду карбону (II) СО у газовій суміші складу 3СО + 5N2 + 2СО2? Яка густина цієї суміші за повітрям? 17.Визначте масу 1 л газової суміші складу (н.у.): СО + 2N2 (генераторний газ). Яка кількість молів і яке число молекул кожного газу знаходяться у цьому об’ємі? 18.Дана газова суміш складу 3СО + 7СО2. Розрахуйте: а) середню молекулярну масу суміші; б) масу 1 л суміші (за н.у.); в) густину суміші за воднем; г) масу 10 л суміші (н.у.); д) об’єм 1 к г суміші (н.у.). 19.Газоподібна речовина масою 0,08 г займає об’єм 11,2 мл за н.у. Розрахуйте молярну, молекулярну маси та масу однієї молекули цього газу. Яка кількість молів речовини і яке число молекул знаходяться у цій масі газу? 20.Яка і в якому об’ємі (н.у.) знаходиться кількість молекулярного азоту (моль), якщо вона містить 1,2 × 1022 молекул? Розрахуйте масу цієї кількості газу. 21.В ємності змішано гази: СО2, О2 і N2, маси яких відповідно становлять 11, 16 і 21 г. В яких об’ємних співвідношеннях змішано ці гази? Розрахуйте середню молекулярну масу цієї газової суміші та її густину за киснем. 22.При згорянні аміаку в кисні у присутності платинового каталізатора утворюються газоподібний оксид нітрогену (II) NO і водяний пар. У яких об’ємних і масових співвідношеннях реагують аміак і кисень? Розрахуйте кількість, масу та об’єм (н.у.) NO, який утворився, якщо прореагувало 10 л (н.у.) NH3. 23.Відносна густина газу за воднем становить 8,5. Чому дорівнює молекулярна, молярна маси цього газу, маса однієї його молекули? Визначте кількість речовини (моль) і об’єм (н.у.), який займає 1,7 к г газу. 24.Двохвалентний метал масою 2 г витісняє з розчину хлоридної кислоти 1,12 л (н.у.) водню. Визначте, який це метал. Чому дорівнює маса водню, який утворився, скільки його молекул містяться у цьому об’ємі? 25.Маса молекули деякої речовини дорівнює 2×10-22 г. Чому дорівнюють молекулярна та молярна маси цієї речовини? Скільки молекул містяться у 10 г речовини? Яку кількість молів це складає?
2. БУДОВА АТОМІВ. ПЕРІОДИЧНИЙ ЗАКОН ТА ПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ ЕЛЕМЕНТІВ Д.І. МЕНДЕЛЄЄВА Задачі 1. Чим відрізняється електронна будова атомів від електронної будови іонів відповідних елементів? Поясніть на прикладах: Mn - Mn2+ - Mn7+; Cl7+ - Cl3+ - Cl - Cl-. Наведіть визначення енергії іонізації та енергії спорідненості до електрона. 2. Напишіть електронні формули атомів Ванадію та Арсену в нормальному та збудженому станах і наведіть їх повний аналіз. 3. Назвіть елемент, що знаходиться у п’ятому періоді табл. Д.І. Менделєєва, вищий оксид якого ЕО2 і який не утворює з Гідрогеном газоподібних сполук. Запишіть і дайте повний аналіз електронної формули цього елемента. 4. Назвіть елемент, що знаходиться у четвертому періоді табл. Д.І. Менделєєва, вищий оксид якого ЕО3 і який з Гідрогеном утворює газоподібну сполуку Н2Е. Запишіть і дайте повний аналіз електронної формули цього елемента. 5. В якому стані - нормальному чи збудженому - знаходиться хлор у сполуках: KClO3, Cl2O7, NaClO2, HCl? Наведіть електронні формули цього елемента для відповідних станів. Дайте пояснення, чому Хлор знаходиться в 3-му періоді, VI групі, головній підгрупі табл. Д.І. Менделєєва і є неметалом? 6. Валентні закінчення електронних формул елементів - 5 s 25 p 4 i 4 d 55 s 1. Назвіть ці елементи. Напишіть відповідні повні електронні формули і дайте їх аналіз. Чому ці елементи знаходяться в одному періоді та групі табл. Д.І. Менделєєва, але в різних підгрупах? 7. У якого елемента 4-го періоду - Хрому чи Селену - більше виявлені металічні властивості? Чому? Який з цих елементів утворює газоподібну сполуку з Гідрогеном? Яку? Відповідь мотивуйте електронною будовою атомів Хрому та Селену. 8. Що є мірою металічних і неметалічних властивостей елементів? Які елементи мають найбільш виявлені неметалічні властивості? Охарактеризуйте їх місце у періодичній системі та будову їх електронних оболонок. 9. Які орбіталі атома заповнюються електронами раніше: 4 s чи 3 d; 5 s чи 4 р? Чому? Складіть і наведіть повний аналіз електронної формули елементу з порядковим номером 21. 10.Які орбіталі атома заповнюються електронами раніше: 4 d чи 5 s; 6 s чи 5 р? Чому? Складіть і наведіть повний аналіз електронної формули елементу з порядковим номером 43. 11.Дайте визначення енергіям іонізації та спорідненості до електрона. Чим відрізняється електронна будова атомів від електронної будови іонів відповідних елементів? Поясніть на прикладах: Р5+, Р3+, Р, Р3-; Fe, Fe2+, Fe3+. 12.Чому Манган виявляє металічні властивості, а Бром - неметалічні? Відповідь обгрунтуйте електронними формулами атомів цих елементів. Чому ці елементи знаходяться в одному періоді та в одній групі, але в різних підгрупах? Вкажіть хімічний характер і напишіть формули оксидів Mn (IV) i Br (VII) та формули відповідних гідроксидів. 13.В якого елемента табл. Д.І. Менделєєва валентними є 5 s 25 p 2-електрони? Напишіть електронну формулу атома цього елемента і зробіть її повний аналіз. 14.Значення 4-х квантових чисел для валентних електронів деякого елемента такі: n = 4, l = 0, ml = 0, m s = +½, m s = -½; n = 4, l = 1, ml = {+1, 0, -1}, m s = +½, m s = +½, m s = +½, m s = -½. Назвіть цей елемент. Напишіть електронну формулу атома та зробіть її повний аналіз. 15.В якого з р -елементів V групи періодичної системи - Фосфору чи Стибію - сильніше виражені неметалічні властивості? Чому? Відповідь обгрунтуйте електронною будовою атомів цих елементів. Дайте повний аналіз електронної формули атомів одного з цих елементів. 16.Манган утворює сполуки, в яких він виявляє ступені окиснення +2, +3, +4, +6, +7. Складіть формули його оксидів і гідроксидів, які відповідають цим ступеням окиснення, і наведіть будову електронних оболонок атома та іонів. 17.Приведіть будови електронних оболонок елементів третього періоду періодичної системи. Складіть формули їх оксидів і гідроксидів, які відповідають найвищому ступеню окиснення. Як змінюється кислотно-основний характер цих сполук при переході від Натрію до Хлору? 18.Напишіть електронну формулу атома елемента і назвіть його, якщо значення квантових чисел (n, l, ml, ms) електронів зовнішнього (останнього) та попереднього енергетичних рівнів такі: 6, 0, 0, ½; 6, 0, 0, -½; 6, 1, -1, ½. Зробіть повний аналіз цієї формули. 19.Напишіть електронну формулу атома елемента і назвіть його, якщо значення квантових чисел (n, l, ml, ms) електронів зовнішнього (останнього) та попереднього енергетичних рівнів такі: 5, 0, 0, ½; 5, 0, 0, -½; 4, 2, -2, ½. Зробіть повний аналіз цієї формули. 20.В атомі елемента знаходиться 7 зовнішніх електронів, розташованих на 5-му енергетичному рівні. У вигляді таблиці наведіть набір 4-х квантових чисел, що характеризують ці електрони. Назвіть цей елемент і дайте пояснення його положення у табл. Д.І. Менделєєва (період, група, підгрупа). 21.Складіть електронні формули атомів елементів, які мають по два електрони: а) на 4 d - і б) на 5 s -атомних орбіталях. Запишіть повні електронні формули цих елементів і наведіть їх повний аналіз. 22.Напишіть електронні формули атомів Флуору і Хлору. Наведіть їх повний аналіз. Чому Флуор у сполуках виявляє єдину валентність, що дорівнює одиниці, а Хлор - I, III, V, VII? 23.Вкажіть, у яких групах і підгрупах періодичної таблиці розташовані елементи з валентними електронами: а) ns 2 np 4; б) (n - 1) d 3 ns 2; в) np 6(n + 1) s 1. Дайте пояснення. Які з наведених груп елементів належать до металів, а які - до неметалів? Наведіть у кожному випадку загальні формули вищих оксидів, вкажіть їх кислотно-основний характер, запишіть формули відповідних гідроксидів. 24.Напишіть електронні формули атомів Фосфору та Ванадію. Зробіть їх повний аналіз. 25.У чому полягає різниця електронної будови атома у нормальному та збудженому станах? Покажіть це на прикладах атомів Карбону, Сульфуру та Брому. Атоми яких елементів можуть бути збудженими? Відповідь обґрунтуйте.
Задачі 1. Поясніть, чому молекула BF3 - плоска, а NF3 - пірамідальна. Відповідь дайте на підставі схем перекривання атомних орбіталей у молекулах цих речовин. Яка з цих молекул полярна і чому? 2. На підставі схем перекривання атомних орбіталей поясніть, чому в молекулах Н2О та NН3 валентні кути Н - Е - Н дорівнюють, відповідно, 104,5 і 107°. 3. Який ковалентний зв’язок називають s-зв’язком і який - p-зв’язком? Відповідь дайте на підставі схем перекривання АО у молекулах азоту й ацетилену. 4. Який хімічний зв’язок називається водневим? Між молекулами яких речовин він утворюється? Чому Н2О і НF, що мають меншу молекулярну масу, плавляться та киплять при більш високих температурах, ніж Н2S і Н2Se; HCl і HBr? 5. Що називають електричним моментом диполя? Яка з молекул - HCl, HBr, НІ - має найбільший момент диполя? Чому? 6. Що є кількісною мірою полярності ковалентного зв’язку? Аналізуючи схеми перекривання атомних орбіталей у молекулах Сl2, Н2О, ВеСl2, визначте, які з них є диполями. 7. Що таке електронегативність? Як змінюється характер хімічного зв’язку в оксидах у ряді: Li2O - BeO - B2O3 - CO2 - V2O5 - Cl2O7? Дайте пояснення. 8. Наведіть схеми перекривання атомних орбіталей у молекулах Сl2, N2 і СН4. Чим пояснюється особлива міцність молекули азоту? Дайте визначення поняттю міцності зв’язку, або енергії зв’язку. 9. Молекули Н2О і CO2 кожна містять по два полярних зв’язки (Н - О - Н і О = С = О). Чому молекула CO2 неполярна, а молекула води полярна? Відповідь дайте на підставі схем перекривання АО у цих молекулах та їх аналізу. 10. Наведіть електронні формули атома Сульфуру в нормальному або збудженому станах у молекулах Н2S, SСl2, SСl4, SСl6. Вкажіть тип гібридизації АО Сульфуру у відповідних молекулах. Які дві з них мають однакові геометричні (просторові) конфігурації? Наведіть схеми перекривання АО в цих молекулах. 11. Що розуміють під гібридизацією атомних орбіталей? Встановіть тип гібридизації АО центрального атома та форму наведених частинок: NН3, NН4+, SiF4, CO2, CO32- (усі три зв’язки С - О рівноцінні та розташовані під кутом 120°). Врахуйте, що в гібридизації можуть брати участь d -атомні орбіталі. 12. Що розуміють під гібридизацією атомних орбіталей? Встановіть тип гібридизації АО центрального атома та форму наведених частинок: РF5, SF6, SiF4, NF3, NН4+ (усі чотири зв’язки N - H рівноцінні та розташовані під кутом 109°28¢). Врахуйте, що у гібридизації можуть брати участь d -атомні орбіталі. 13. У чому відмінність p-зв’язку від s-зв’язку? Як він утворюється? Чи є енергетично рівноцінними ці види зв’язку? Відповідь поясніть на прикладі схем перекривання АО в молекулах С2Н4 і С2Н2. 14. Дайте визначення поняттю електричного моменту диполя. Яка з молекул - BF3, NF3 чи РF3 - має нульове значення цієї величини? Відповідь дайте на підставі схем перекривання АО у молекулах та їх аналізу. 15. Дайте визначення поняттю насиченості ковалентного зв’язку. Відповідь поясніть на прикладі молекул СО і СН4. Наведіть схеми перекривання АО в цих молекулах. 16. Поясніть поняття напрямленості хімічного зв’язку в молекулах з точки зору методу валентних зв’язків. Відповідь проілюструйте на прикладах схем перекривання АО у молекулах ВеСl2 і SСl2. 17. Які типи хімічного зв’язку Ви знаєте? Як змінюється характер хімічного зв’язку в ряді: NaCl - MgCl2 - AlCl3 - SiCl4 - PCl5 - SCl2 - Cl2? Чому? 18. Поясніть, що таке s- та p-зв’язки? На підставі структурних формул вкажіть, скільки s- та p-зв’язків містять молекули: SF6, СCl4, SО3, PCl5, PОCl3, С2Н4, С2Н2, СОCl2, SО2Cl2. Наведіть схеми перекривання АО в молекулі СCl4. Який тип гібридизації АО Карбону в цій молекулі? 19. Який ковалентний зв’язок називають полярним, а який - неполярним? Чи завжди при наявності полярних зв’язків молекула теж полярна? Відповідь поясніть на прикладах схем перекривання АО в молекулах SnСl2 і SnСl4 та їх аналізу. 20. Що називають гібридизацією атомних орбіталей? Наведіть приклади молекул з sp -, sp 2- i sp 3-гібридизацією АО центрального атома. Які з цих молекул полярні? 21. Який тип гібридизації АО центрального атома у молекулах: BeH2, SiH4, CS2, BBr3? Наведіть схеми перекривання АО в молекулах BeH2 і SiH4. Чому обидві молекули неполярні? 22. Складіть електронні формули атомів і наведіть схеми перекривання АО в молекулах ІnCl та InCl3. В якій з молекул відбувається гібридизація АО Індію? Вкажіть тип гібридизації та зробіть висновок про полярність молекул. 23. Яку геометричну форму можуть мати трьохатомні молекули типу АВ2? Розгляньте це на прикладі молекул BeCl2, ZnBr2, CO2, H2O. Які з них полярні і чому? 24. Чому однотипні за атомним складом молекули CO2 і SO2, BCl3 i PCl3 мають різну геометричну конфігурацію? Наведіть приклади перекривання АО в молекулах BCl3 i PCl3. Яка з них полярна і чому? 25. Наведіть схеми перекривання АО в молекулах O2 і H2O. Вкажіть типи гібридизації АО Оксигену, число s- та p-зв’язків, полярність зв’язків і наявність полярності для кожної молекули. Задачі 1. Кристалічний хлорид амонію утворюється при взаємодії газоподібних аміаку та хлориду гідрогену. Напишіть термохімічне рівняння цієї реакції, розрахувавши її тепловий ефект за стандартних умов (D Н 0). Скільки виділилося теплоти, якщо у ході реакції було витрачено 10 л аміаку (н.у.)? Як змінилося значення ентропії в цій реакції? Відповідь дайте на підставі аналізу рівняння, що зв’язує D G, D S i D H. 2. Стандартний тепловий ефект реакції згоряння рідкого бензолу з утворенням пари води та діоксиду карбону дорівнює D Н 0298 = -3135,58 кДж. Складіть термохімічне рівняння цієї реакції, розрахуйте стандартну ентальпію утворення рідкого С6Н6 і тепловий ефект
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.161.119 (0.011 с.) |

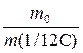 .
.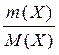 =
= 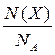 ,
,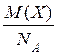 .
.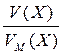 .
.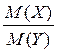 .
.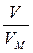 =
= 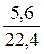 = 0,25 (моль).
= 0,25 (моль).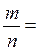
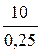 = 40 (г /моль).
= 40 (г /моль).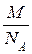 =
= 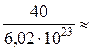 6,66 × 10-23 (г).
6,66 × 10-23 (г). = 26,7 (г).
= 26,7 (г).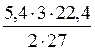 = 6,72 (л).
= 6,72 (л).


