
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ознакою перебігу хімічної реакції є утворення або розчинення осаду.Содержание книги
Поиск на нашем сайте
Використовуючи набуті знання про властивості сполук, запропонуйте план виконання контрольного завдання.
Дослід 1. Добування та властивості гідроксидів металів: 1. У дві пробірки внесіть 1-2 мл солі “а” та додайте у кожну з них декілька крапель розчину гідроксиду натрію (NaOH) до утворення осаду гідроксиду відповідного металу. Для визначення хімічного характеру гідроксиду металу до вмісту першої пробірки додайте розчин нітратної кислоти (HNO3), до вмісту другої – надлишок розчину NaOH. В якому випадку осад розчиняється? Зробіть висновок про хімічних характер гідроксиду металу (основний чи амфотерний) та складіть рівняння відповідних реакцій. 2. Повторіть дослід у тому ж порядку з розчином солі “б”.
Дослід 2. Контрольний дослід Визначте, у якій зі склянок з номерами, що надає викладач, знаходяться розчини солей “а” і “б”, використовуючи тільки розчин лугу. Лабораторна робота №2 Теплові ефекти процесів
Мета роботи – визначити масу розчиненої сполуки за кількістю теплоти, що виділяється або поглинається при її розчиненні. Порядок виконання роботи 1. Отримайте у викладача завдання: назву (формулу) сполуки, яку слід розчинити у певному об’ємі води V (Н2О), мл. 2. У внутрішню склянку спрощеного калориметра налийте зазначений об’єм води та заміряйте її температуру t 1, °С. 3. Не виймаючи термометра, всипте у воду кристали сполуки. Обережно розмішуючи суміш термометром, досягніть максимального розчинення сполуки та визначте найвищу (або найнижчу) температуру t 2, °С.
Обробка результатів 1. Обчисліть кількість теплоти q, що виділяється або поглинається при розчиненні виданої кількості сполуки, вважаючи, що густина розчину дорівнює 1 г /мл, об’єм розчину – об’єму води, а теплоємність розчину – теплоємності води с = 4,18 Дж/(г × К):
2. Розрахуйте масу розчиненої сполуки m, використовуючи табличне значення стандартної молярної ентальпії розчинення D Н 0розч. і молярну масу сполуки М. Вихідні дані та результати досліду занесіть у таблицю.
Лабораторна робота №3 Хімічна кінетика
Мета роботи – вивчити залежність швидкості реакції від концентрації реагуючих речовин на прикладі реакції, яка перебігає у розчині між тіосульфатом натрію та сульфатною кислотою: Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S¯. Про швидкість реакції роблять висновок за величиною, зворотною до часу, який пройшов з моменту зливання розчинів до появи в усіх дослідах однакового помутніння внаслідок утворення сірки.
Порядок виконання роботи 1. Отримайте у викладача завдання: об’єм розчину тіосульфату натрію (а), об’єм води (b), об’єм розчину сульфатної кислоти (с). 2. Налийте з першої бюретки у три пронумеровані склянки зазначені у Вашому варіанті об’єми тіосульфату натрію з концентрацією С (Na2S2O3) = 0,1 моль/л. З другої бюретки додайте до кожної склянки відповідний об’єм дистильованої води. 3. У кожну склянку прилийте зазначений у варіанті об’єм розчину сульфатної кислоти з концентрацією С (H2SO4) = 1 моль/л, відмірюючи його циліндром. Відзначте час з моменту зливання розчинів до моменту появи помутніння.
Обробка результатів 1. Розрахуйте концентрацію тіосульфату натрію та сульфатної кислоти у кожній склянці: С (Na2S2O3) 2. Розрахуйте відносну швидкість реакції для кожної склянки: v = 100/t, с-1. 3. Побудуйте графік залежності відносної швидкості реакції від концентрації Na2S2O3, відкладаючи на осі абсцис концентрацію тіосульфату натрію, а на осі ординат – відносну швидкість реакції. 4. Запишіть математичний вираз закону діючих мас для досліджуваного процесу та розрахуйте умовну константу швидкості реакції. Чи залежить константа швидкості реакції від концентрації реагуючих речовин? Занесіть результати у таблицю.
Лабораторна робота №4 Розчини електролітів
Мета роботи – ознайомитися з властивостями розчинів електролітів.
1. Одержання та дослідження особливостей слабких електролітів а) утворення малорозчинних сполук. Налийте у пробірку» 1 мл розчину нітрату плюмбуму Pb(NO3)2 і додайте такий самий об’єм розчину хлориду натрію NaCl. Після перемішання спостерігайте утворення осаду хлориду плюмбуму. Відзначте колір осаду. Додайте до вмісту пробірки декілька крапель розчину іодиду калію. Як і чому змінюється колір осаду? Далі налийте у пробірку розчин сульфіду натрію Na2S (витяжна шафа!). і знов відзначте зміну кольору осаду. Складіть рівняння всіх реакцій, що перебігають. Використовуючи спостереження, порівняйте розчинність хлориду, іодиду та сульфіду плюмбуму. б) утворення малодисоційованої сполуки. Налийте у дві пробірки» 1 мл розчину хлориду барію і додайте в одну з них декілька крапель розчину сульфату натрію, а в іншу – розчину карбонату натрію. Складіть іонно-молекулярні рівняння реакцій. До вмісту обох пробірок додайте» 1 мл розчину оцтової кислоти. У якому випадку перебігає реакція? Складіть іонно-молекуярні рівняння реакцій. Використовуючи спостереження, порівняйте силу сульфатної, оцтової та карбонатної кислот.
2. Визначення рН контрольного розчину електроліту Смужку універсального індикаторного паперу занурте на декілька секунд у досліджуваний розчин. Порівнюючи забарвлення вологої смужки паперу зі шкалою кольорів, знайдіть приблизне значення рН розчину. Розрахуйте концентрацію іонів Гідрогену та гідроксильних іонів у розчині. Кислий він чи лужний?
Лабораторна робота №5 Електрохімічні процеси
Мета роботи – ознайомитися з головними об’єктами електрохімічних досліджень.
1. Мідно-цинковий гальванічний елемент Налийте у скляний стакан на третину розчин сульфату купруму, а у керамічний - розчин сульфату цинку з концентрацією солей у розчинах 0,1 моль/л. Поставте керамічний стакан у скляний. Мідну та цинкову пластини занурте у розчини їх солей. Приєднайте електроди провідниками до клем вольтметра та виміряйте напругу. За рівнянням Нернста розрахуйте ЕРС гальванічного елемента та порівняйте одержане значення з визначеним експериментально. Наведіть схему гальванічного елемента, складіть рівняння електродних реакцій та сумарної струмоутворюючої реакції.
2. Контактна корозія Сталеві (залізні) скріпки, з’єднані зі шматочками міді, олова та цинку, помістіть у три пробірки. У кожну пробірку додайте розчин сульфатної кислоти, який містить червону кров’яну сіль K3[Fe(CN)6]. Спостерігайте за кольором розчину. При появі у розчині іонів Fe2+ виникає синє забарвлення внаслідок взаємодії: 3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2¯. У якій з пробірок синє забарвлення розчину з’являється раніше? Чому? Складіть три схеми корозійних ГЕ та рівняння електродних процесів. Який з металів, що контактує із залізом, захищає його від корозії?.
3. Електроліз 1. Електроліз водного розчину іодиду калію. Скляну U-подібну трубку заповніть на 2/3 розчином іодиду калію. Додайте 1-2 мл розчину крохмалю та 2-3 краплі фенолфталеїну. Опустіть у розчин вугільні електроди, підключіть їх до джерела постійного струму та проведіть електроліз до появи забарвлення (якого?) у катодному й анодному просторі. Складіть рівняння електродних процесів. 2. Електроліз водного розчину сульфату купруму. Опустіть вугільні електроди у склянку з розчином сульфату купруму, підключіть їх до джерела струму. Електроліз проводьте, доки один з електродів (який?) на вкриється шаром міді. Складіть рівняння електродних процесів. Поміняйте місцями полюси джерела струму та проведіть електроліз до появи міді на іншому вугільному електроді. При цьому мідь на першому вугільному електроді повинна майже повністю розчинитися. Складіть рівняння електродних процесів.
Лабораторна робота №6 Окисно-відновні реакції
Мета роботи – дослідити властивості типових окисників і відновників 1. Окисні властивості сульфатної кислоти. 1. У дві пробірки налийте 5-6 крапель концентрованої сульфатної кислоти (обережно!). В одну з них опустіть гранулу цинку, в іншу – мідь. Вміст пробірок трохи нагрійте (витяжна шафа!). До отвору кожної пробірки піднесіть смужку фільтрувального паперу, змоченого розчином нітрату плюмбуму (ІІ) Pb(NO3)2. Одна зі смужок паперу повинна почорніти внаслідок виділення сірководню та утворення чорного сульфіду плюмбуму PbS: Pb(NO3)2 + H2S = PbS¯+ 2HNO3. Який газ виділяється з іншої пробірки? Складіть рівняння реакцій, вкажіть атом-окисник та атом-відновник. 2. Подійте розведеною сульфатною кислотою на мідь і цинк. У якому разі і чому реакція не перебігає? Атом якого елемента у молекулі кислоти є окисником? Складіть рівняння реакцій.
2. Окисні властивості іонів металу. 1. У пробірку налийте 2-3 краплі розчину хлориду феруму (ІІІ) FeCl3 та додайте такий самий об’єм розчину іодиду калію KI. Чому змінився колір розчину? Складіть рівняння реакцій, враховуючи, що продукт відновлення – іон Fe2+. 2. У дві пробірки налийте 2-3 мл розчину нітрату плюмбуму (ІІ). В одну з пробірок занурте гранулу цинку, а в іншу – міді. На якому з металів осаджується свинець і чому? Складіть рівняння реакцій. Використовуючи спостереження, розташуйте іони цинку, міді та плюмбуму в порядку зменшення їх окислювальних властивостей.
3. Окисно-відновна двоїстість пероксиду гідрогену 1. Налийте у пробірку декілька крапель розчину перманганату калію KMnO4. Додайте» 1 мл розчину сульфатної кислоти і по краплях додавайте розчин пероксиду гідрогену Н2О2 до знебарвлення розчину. Яку роль відіграє пероксид гідрогену в цій реакції – окисника чи відновника? KMnO4 + Н2О2 + H2SO4 ® MnSO4 + О2 + K2SO4 + Н2О. 2. Налийте у пробірку» 1 мл розчину іодиду калію і такий самий об’єм розчину розведеної сульфатної кислоти. Додайте декілька крапель пероксиду гідрогену. Що при цьому спостерігається? Яку роль відіграє пероксид гідрогену в цій реакції – окисника чи відновника? KІ + Н2О2 + H2SO4 ® І2 + K2SO4 + Н2О. У наведених рівняннях розставте коефіцієнти методом електронного балансу.
IV. ДОДАТКИ Додаток 1 Відносна електронегативність s - та p -елементів
Додаток 2 Стандартні ентальпії
Додаток 3 Стандартні енергії Гіббса
Додаток 4 Стандартніпотенціали j0 металічних електродів
Додаток 5 Розчинність солей та основ у воді
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
1. Глінка М. Л. Загальна хімія: Пер. з 20-го рос. вид. - К.: Вища шк., 1982. - 608 с. 2. Коровин Н. В. Общая химия. - М.: Высш. шк., 1998. - 558 с. 3. Рейтер Л. Г., Степаненко О. М., Басов В. П. Теоретичні розділи загальної хімії. - К.: “Каравела”, 2003. - 351 с. 4. Глінка М. Л. Задачі та вправи з загальної хімії: Пер. з 5-го рос. вид. - К.: Держтехвидав, 1983. - 263 с. 5. Краткий справочник физико-химических величин / Под ред. А. А. Равделя, А. М. Пономаревой. - Л.: Химия, 1983. - 232 с.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 208; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.99.221 (0.007 с.) |


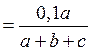 ; С (H2SO4)
; С (H2SO4)  .
. утворення деяких речовин
утворення деяких речовин утворення деяких речовин
утворення деяких речовин Li
Li 



