
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічний зв’язок і будова молекулСодержание книги
Поиск на нашем сайте
Короткі теоретичні відомості
s - s s - p p - p Деякі молекули мають дві області перекривання атомних орбіталей, які знаходяться над і під площиною, де знаходяться ядра взаємодіючих атомів та s- зв’язки, таким чином додатково виникає так званий p- зв’язок:
p - р p – d d – d Усі s-зв’язки багатовалентного атома однакові, тобто цей атом має на АО однотипні валентні електрони. У випадку різнотипних валентних електронів відбувається гібридизація відповідних електронних орбіталей. Гібридні орбіталі мають лише таку форму:
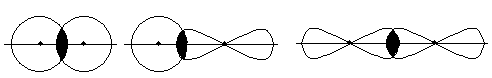
Розглянемо основні типи гібридизації АО. Якщо атом двохвалентного елемента має валентні електрони ns 2 np
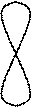
90°
гібридизація відсутня sp -гібридизація Для атомів трьохвалентних елементів з неспареними електронами, розташованими на ns
90°
гібридизація відсутня sp 2-гібридизація
Для атома чотирьохвалентного елемента, в якого валентні електрони у збудженому стані знаходяться на ns
sp 3-гібридизація При розв’язанні задач цього розділу потрібно розуміти різницю між полярністю зв’язку та полярністю молекули у цілому.Полярність зв’язкупов’язана з наявністю ефективних (реальних) зарядів (d±) на атомах після утворення ковалентного зв’язку. Найпростіше вона оцінюється за різницею електронегативностей атомів (ЕН, або c, див. додаток, табл.1). Якщо ця різниця (DЕН) менша за 1,9, утворюється ковалентний полярний зв’язок, наприклад: С DЕН 0,4 0,5 0 полярні зв’язки неполярний зв’язок При При наявності полярних зв’язків молекула у залежності від її будови може бути як полярною, так і неполярною. Якщо центри всіх позитивних і негативних зарядів співпадають у просторі, молекула неполярна; якщо не співпадають – молекула полярна. Так, молекули типу АВ2 трикутної форми полярні, молекули типу АВ2 лінійної форми неполярні. Задачі 1. Поясніть, чому молекула BF3 - плоска, а NF3 - пірамідальна. Відповідь дайте на підставі схем перекривання атомних орбіталей у молекулах цих речовин. Яка з цих молекул полярна і чому? 2. На підставі схем перекривання атомних орбіталей поясніть, чому в молекулах Н2О та NН3 валентні кути Н - Е - Н дорівнюють, відповідно, 104,5 і 107°. 3. Який ковалентний зв’язок називають s-зв’язком і який - p-зв’язком? Відповідь дайте на підставі схем перекривання АО у молекулах азоту й ацетилену. 4. Який хімічний зв’язок називається водневим? Між молекулами яких речовин він утворюється? Чому Н2О і НF, що мають меншу молекулярну масу, плавляться та киплять при більш високих температурах, ніж Н2S і Н2Se; HCl і HBr? 5. Що називають електричним моментом диполя? Яка з молекул - HCl, HBr, НІ - має найбільший момент диполя? Чому? 6. Що є кількісною мірою полярності ковалентного зв’язку? Аналізуючи схеми перекривання атомних орбіталей у молекулах Сl2, Н2О, ВеСl2, визначте, які з них є диполями.
7. Що таке електронегативність? Як змінюється характер хімічного зв’язку в оксидах у ряді: Li2O - BeO - B2O3 - CO2 - V2O5 - Cl2O7? Дайте пояснення. 8. Наведіть схеми перекривання атомних орбіталей у молекулах Сl2, N2 і СН4. Чим пояснюється особлива міцність молекули азоту? Дайте визначення поняттю міцності зв’язку, або енергії зв’язку. 9. Молекули Н2О і CO2 кожна містять по два полярних зв’язки (Н - О - Н і О = С = О). Чому молекула CO2 неполярна, а молекула води полярна? Відповідь дайте на підставі схем перекривання АО у цих молекулах та їх аналізу. 10. Наведіть електронні формули атома Сульфуру в нормальному або збудженому станах у молекулах Н2S, SСl2, SСl4, SСl6. Вкажіть тип гібридизації АО Сульфуру у відповідних молекулах. Які дві з них мають однакові геометричні (просторові) конфігурації? Наведіть схеми перекривання АО в цих молекулах. 11. Що розуміють під гібридизацією атомних орбіталей? Встановіть тип гібридизації АО центрального атома та форму наведених частинок: NН3, NН4+, SiF4, CO2, CO32- (усі три зв’язки С - О рівноцінні та розташовані під кутом 120°). Врахуйте, що в гібридизації можуть брати участь d -атомні орбіталі. 12. Що розуміють під гібридизацією атомних орбіталей? Встановіть тип гібридизації АО центрального атома та форму наведених частинок: РF5, SF6, SiF4, NF3, NН4+ (усі чотири зв’язки N - H рівноцінні та розташовані під кутом 109°28¢). Врахуйте, що у гібридизації можуть брати участь d -атомні орбіталі. 13. У чому відмінність p-зв’язку від s-зв’язку? Як він утворюється? Чи є енергетично рівноцінними ці види зв’язку? Відповідь поясніть на прикладі схем перекривання АО в молекулах С2Н4 і С2Н2. 14. Дайте визначення поняттю електричного моменту диполя. Яка з молекул - BF3, NF3 чи РF3 - має нульове значення цієї величини? Відповідь дайте на підставі схем перекривання АО у молекулах та їх аналізу. 15. Дайте визначення поняттю насиченості ковалентного зв’язку. Відповідь поясніть на прикладі молекул СО і СН4. Наведіть схеми перекривання АО в цих молекулах. 16. Поясніть поняття напрямленості хімічного зв’язку в молекулах з точки зору методу валентних зв’язків. Відповідь проілюструйте на прикладах схем перекривання АО у молекулах ВеСl2 і SСl2. 17. Які типи хімічного зв’язку Ви знаєте? Як змінюється характер хімічного зв’язку в ряді: NaCl - MgCl2 - AlCl3 - SiCl4 - PCl5 - SCl2 - Cl2? Чому? 18. Поясніть, що таке s- та p-зв’язки? На підставі структурних формул вкажіть, скільки s- та p-зв’язків містять молекули: SF6, СCl4, SО3, PCl5, PОCl3, С2Н4, С2Н2, СОCl2, SО2Cl2. Наведіть схеми перекривання АО в молекулі СCl4. Який тип гібридизації АО Карбону в цій молекулі? 19. Який ковалентний зв’язок називають полярним, а який - неполярним? Чи завжди при наявності полярних зв’язків молекула теж полярна? Відповідь поясніть на прикладах схем перекривання АО в молекулах SnСl2 і SnСl4 та їх аналізу. 20. Що називають гібридизацією атомних орбіталей? Наведіть приклади молекул з sp -, sp 2- i sp 3-гібридизацією АО центрального атома. Які з цих молекул полярні? 21. Який тип гібридизації АО центрального атома у молекулах: BeH2, SiH4, CS2, BBr3? Наведіть схеми перекривання АО в молекулах BeH2 і SiH4. Чому обидві молекули неполярні? 22. Складіть електронні формули атомів і наведіть схеми перекривання АО в молекулах ІnCl та InCl3. В якій з молекул відбувається гібридизація АО Індію? Вкажіть тип гібридизації та зробіть висновок про полярність молекул.
23. Яку геометричну форму можуть мати трьохатомні молекули типу АВ2? Розгляньте це на прикладі молекул BeCl2, ZnBr2, CO2, H2O. Які з них полярні і чому? 24. Чому однотипні за атомним складом молекули CO2 і SO2, BCl3 i PCl3 мають різну геометричну конфігурацію? Наведіть приклади перекривання АО в молекулах BCl3 i PCl3. Яка з них полярна і чому? 25. Наведіть схеми перекривання АО в молекулах O2 і H2O. Вкажіть типи гібридизації АО Оксигену, число s- та p-зв’язків, полярність зв’язків і наявність полярності для кожної молекули.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 318; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.225.27 (0.008 с.) |

 З усіх типів хімічного зв’язку в молекулах найбільш поширеним є ковалентний зв’язок, який утворюється внаслідок перекривання АО з неспареними електронами взаємодіючих атомів. У першу чергу виникає так званий s- зв’язок, коли АО перекриваються вздовж прямої лінії - лінії зв’язку, що з’єднує ядра взаємодіючих атомів:
З усіх типів хімічного зв’язку в молекулах найбільш поширеним є ковалентний зв’язок, який утворюється внаслідок перекривання АО з неспареними електронами взаємодіючих атомів. У першу чергу виникає так званий s- зв’язок, коли АО перекриваються вздовж прямої лінії - лінії зв’язку, що з’єднує ядра взаємодіючих атомів:

 p
p  або ns 2 np
або ns 2 np  p
p  , тобто якщо два неспарені електрони розташовані на орбіталях одного типу (р), гібридизація відсутня. Молекула у цьому випадку кутова, значення валентного кута дорівнює 90° і співпадає з розташуванням р -орбіталей у просторі. Якщо ж атоммає у збудженому стані ns
, тобто якщо два неспарені електрони розташовані на орбіталях одного типу (р), гібридизація відсутня. Молекула у цьому випадку кутова, значення валентного кута дорівнює 90° і співпадає з розташуванням р -орбіталей у просторі. Якщо ж атоммає у збудженому стані ns  np
np 

 np
np  -підрівнях (нормальний стан) або ns
-підрівнях (нормальний стан) або ns 



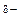 - Н
- Н  , С
, С  , C0 - S0
, C0 - S0 ЕН > 1,9 утворюється іонний зв’язок, який можна розглядати як граничний варіант ковалентного полярного зв’язку.
ЕН > 1,9 утворюється іонний зв’язок, який можна розглядати як граничний варіант ковалентного полярного зв’язку.


