
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електрохімічні процеси. Гальванічні елементиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Короткі теоретичні відомості Електрохімічними називають хімічні процеси, які відбуваються за рахунок підведеної ззовні електричної енергії, або, навпаки, самі є джерелом її утворення. Вихідним поняттям у електрохімії є поняття про електродний потенціал (j), який вимірюють у вольтах. j - кількісна величина, що характеризує здатність окисно-відновної системи до окиснення та відновлення. Чим менше її значення, тим легше окислюється відновлена форма системи (Red); чим воно більше, тим легше проходить процес відновлення окисленої форми (Ox). Рівняння Нернста характеризує залежність j від природи окисно-відновної системи, концентрації потенціалутворюючих іонів і температури. Для стандартних умов рівняння Нернста має вигляд: jOx/Red = j0Ox/Red + де j0Ox/Red - стандартний електродний потенціал системи, z - число електронів у електродній реакції, [Ox], [Red] – концентрації окисленої та відновленої форм системи відповідно. Для металічних електродів рівняння Нернста спрощується до: j = j0 + а для водневого електрода: j Гальванічний елемент – це технічний пристрій, в якому енергія окисно-відновної реакції безпосередньо перетворюється на електричну за рахунок розділення у просторі процесів окиснення (анод) і відновлення (катод). Необхідно пам’ятати, що ЕРС = Приклад. Складіть схему гальванічного елемента, утвореного пластинками з цинку та заліза, зануреними у розчини солей цих металів з концентраціями відповідно 0,01 і 0,1 моль/л. Запишіть рівняння електродних реакцій та сумарної струмоутворюючої реакції. Розрахуйте ЕРС гальванічного елемента. Розв’язання. Для визначення анода та катода у більшості випадків достатньо скористатись значеннями стандартних електродних потенціалів (див. додаток, табл.4):
Рівняння анодного процесу: А(-): Zn0 - 2 e = Zn2+. Анод негативно заряджений відносно зовнішнього електричного кола. Рівняння катодного процесу: К(+): Fe2+ + 2 e = Fe0. Катод позитивно заряджений відносно зовнішнього електричного кола. Якщо скласти два рівняння, одержимо рівняння сумарної струмоутворюючої реакції в іонно-молекулярному вигляді:
Zn2+ + Fe0 = Zn0 + Fe2+, або у молекулярному вигляді: ZnSO4 + Fe = Zn + FeSO4. Схема гальванічного елемента записується так: Zn0 | Zn2+ || Fe2+ |Fe0. Вертикальною рискою позначено межу між електродом та електролітом, двома рисками – межу поділу між електролітами (пориста перегородка). Розраховуємо значення потенціалів анода та катода згідно з рівнянням Нернста:
Тоді ЕРС = Задачі 1. Складіть схеми двох гальванічних елементів, в одному з яких нікель негативно заряджений відносно зовнішнього кола, а в іншому – позитивно. Запишіть рівняння електродних процесів і сумарних струмоутворюючих реакцій. Розрахуйте значення стандартних електрорушійних сил цих елементів. Як залежить величина потенціалу водневого електрода від рН розчину, в який його занурено? Складіть схему гальванічного елемента, утвореного водневим електродом з певним значенням рН і електродом, виконаним з якогось металу, зануреного в розчин солі цього ж металу з указаною концентрацією. Запишіть рівняння електродних процесів, сумарної струмоутворюючої хімічної реакції. Розрахуйте величину електрорушійної сили цього гальванічного елемента. 2. рН = 4, магній, [Mg2+] = 0,1 моль/л. 3. рН = 6, залізо, [Fe2+] = 0,01 моль/л. 4. рН = 7, мідь, [Cu2+] = 1 моль/л. 5. рН = 10, алюміній, [Al3+] = 0,001 моль/л. 6. ЕРС гальванічного елемента, утвореного з алюмінієвої пластинки, зануреної у розчин солі алюмінію з концентрацією 0,003 моль/л, і платинової пластинки, насиченої воднем і зануреної в розчин хлоридної кислоти, дорівнює 1,48 В. Складіть схему гальванічного елемента, запишіть рівняння електродних процесів та сумарної струмоутворюючої хімічної реакції. Визначте концентрацію хлоридної кислоти в розчині. 7. Гальванічний елемент утворено з заліза, зануреного у розчин його солі з концентрацією іонів Fe2+, що дорівнює 0,001 моль/л, і з міді, зануреної у розчин її солі. Якої концентрації повинен бути розчин солі міді, щоб ЕРС кола дорівнювала нулю? Складіть схему гальванічного елемента, запишіть рівняння електродних процесів і сумарної струмоутворюючої хімічної реакції. 8. Складіть схему гальванічного елемента, утвореного з заліза та свинцю, зануреними у розчини їх солей з концентраціями, що дорівнюють 0,05 моль/л кожна. Запишіть рівняння електродних процесів і сумарної струмоутворюючої хімічної реакції та розрахуйте ЕРС елемента.
9. ЕРС гальванічного елемента, утвореного з нікелю, зануреного у розчин його солі з концентрацією іонів Ni2+, що дорівнює 1×10-4 моль/л, і зі срібла, зануреного у розчин його солі, дорівнює 1,108 В. Визначте концентрацію іонів Ag+ у розчині його солі. Складіть схему гальванічного елемента, запишіть рівняння електродних процесів і сумарної струмоутворюючої хімічної реакції. Складіть схему гальванічного елемента, в основі якого лежить реакція, що перебігає за наведеним рівнянням. Напишіть електродні рівняння анодного та катодного процесів. Розрахуйте ЕРС цього елемента, знаючи концентрації солей металів. 10. Ni + Pb(NO3)2 = Ni(NO3)2 + Pb; [Ni2+] = 0,01 моль/л, [Pb2+] = 0,0001 моль/л. 11. Mg + FeSO4 = MgSO4 + Fe; [Mg2+] = 0,1 моль/л, [Fe2+] = 0,1 моль/л. 12. Fe + 2AgNO3 = Fe(NO3)2 + 2Ag; [Fe2+] = 0,01 моль/л, [Ag+] = 0,1 моль/л. 13. 2Al + 3Ni2+ = 2Al3+ + 3Ni; [Al3+] = 0,001 моль/л, [Ni2+] = 0,01 моль/л. 14. Cu + Hg2+ = Cu2+ + Hg; [Cu2+] = 0,1 моль/л, [Hg2+] = 1 моль/л. 15. Zn + Cd2+ = Zn2+ + Cd; [Zn2+] = 0,01 моль/л, [Cd2+] = 1 моль/л. З чотирьох наведених нижче металів виберіть ті пари, які дають найбільшу та найменшу стандартну ЕРС складеного з них гальванічного елемента. Для будь-якого з них складіть схему, запишіть рівняння електродних процесів і сумарної струмоутворюючої хімічної реакції. Розрахуйте ЕРС цього гальванічного елемента, якщо концентрації солей металів для анода і катода дорівнюють 0,01 і 0,1 моль/л відповідно. 16. Ag, Cu, Al i Sn. 17. Mg, Zn, Ni i Hg. 18. Co, Fe, Ca i Zn. 19. Cd, Cr, Be i Sn. 20. ЕРС гальванічного елемента, утвореного з магнію, зануреного у розчин його солі з концентрацією іонів Mg2+, що дорівнює 1,8×10-5 моль/л, і з цинку, зануреного у розчин його солі, дорівнює 1,700 В. Визначте концентрацію іонів Zn2+ у розчині його солі. Складіть схему гальванічного елемента, запишіть рівняння електродних процесів і сумарної струмоутворюючої хімічної реакції. Складіть схеми двох гальванічних елементів, в одному з яких наведений нижче метал був би анодом, а в іншому – катодом. Для кожного гальванічного елемента запишіть рівняння електродних процесів і сумарної струмоутворюючої хімічної реакції, розрахуйте стандартну ЕРС. 21. Zn. 22. Fe. 23. Sn. 24. Cu. 25. Який гальванічний елемент називають концентраційним? Складіть схему, напишіть рівняння електродних процесів і розрахуйте ЕРС гальванічного елемента, що утворений із срібних електродів, занурених у розчини AgNO3 з концентраціями 0,01 і 0,1 моль/л.
|
||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 485; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.32.251 (0.011 с.) |


 ,
, [Me z +],
[Me z +], = 0,059lg[H+] = - 0,059pH.
= 0,059lg[H+] = - 0,059pH. >
> 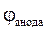 . Електрорушійна сила гальванічного елемента (ЕРС, або просто Е) розраховується як різниця потенціалів:
. Електрорушійна сила гальванічного елемента (ЕРС, або просто Е) розраховується як різниця потенціалів: = - 0,76 B <
= - 0,76 B <  = - 0,44 B, тому анодом є цинк.
= - 0,44 B, тому анодом є цинк. = - 0,76 +
= - 0,76 +  = - 0,76 +
= - 0,76 +  » - 0,82 В,
» - 0,82 В, = - 0,44 +
= - 0,44 +  » - 0,47 В.
» - 0,47 В. -
-  = - 0,47 - (- 0,82) = 0,35 В.
= - 0,47 - (- 0,82) = 0,35 В.


