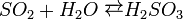Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Загальна характеристика елементів VIIА групи періодичної системиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Білет 1 Загальна характеристика елементів VIIА групи періодичної системи
Реагують майже з усіма простими речовинами, крім деяких неметалів. Всі галогени - енергійні окислювачі, тому зустрічаються в природі тільки у вигляді сполук. Зі збільшенням порядкового номера хімічна активність галогенів зменшується, хімічна активність галогенід-іонів F -, Cl -, Br -, I -зменшується. До галогенам відносяться фтор F, хлор Cl, бром Br, йод I Являють собою: Фтор - зеленувато-жовтий газ, дуже отруйний і реакционноспособен. Хлор - зеленуватий газ. Важкий, також дуже отруйний, має характерний неприємний запах (запах хлорки). Бром - червоно-бура рідина. Отруйна. Вражає нюховий нерв. Дуже леткий, тому міститься в запаяних ампулах. Йод - фіолетово-чорні кристали. Дуже легко переганяється (пари фіолетового кольору). Отруйний. Неметали. На зовнішньому енергетичному рівні 7 електронів, є сильними окислювачами. При взаємодії з металами виникає іонний зв'язок, і утворюються солі. Можуть бути і відновниками (крім F) при взаємодії з більш електронегативними елементами. Від хлору до йоду енергія зв'язку поступово слабшає, що пов'язано зі збільшенням атомного радіусу. Добування галогенів. Фтор добувають електролізом розчину KHF2 у безводній HF; Хлор: електролізом водного розчину натрій хлориду (промисловий спосіб); взаємодією сильних окисників з хлоридною кислотою (лабораторний спосіб):
Застосування галогенів. Фтор широко застосовують для синтезу хладоагентів і полімерних матеріалів – фреонів, тефлону, флуоропластиків, що відрізняються високою хімічною стійкістю до дії концентрованих кислот, лугів, розчинників, окисників. З флуоропласту виготовляють хімічну апаратуру. Рідкий фтор використовують як окисник ракетного палива, а сполуки Флуору – в медицині. Хлор використовують для знезаражування питної води, як окисник у різних галузях хімічної промисловості, у металургії кольорових металів для очищення їх. Бром і йод в основному застосовують у виробництві ліків, для різних синтезів і в хімічному аналізі. Йод використовують як антисептичний і кровоспинний засіб.
Марганець - елемент побічної підгрупи сьомої групи четвертого періоду періодичної системи хімічних елементів Д. І. Менделєєва, з атомним номером 25. Атоми цих елементів характеризуються недобудованою (n-1) d-електронною оболонкою. Важкі аналоги марганцю у гетероатомних сполуках проявляють високі ступені окиснення, насамперед +7, тоді як для Mn характерні ще й інші ступені окиснення - насамперед +2. Семивалентний манган - сильний окисник.
Манган входить в число 26 найпоширеніших елементів і давно відомий людству. Елементи підгрупи мангану непарні, вони мають бідний ізотопний склад. Наприклад, манган - елемент-одинак. В природі марганець знаходиться у вигляді оксигеновмісних сполук. Сполуки марганцю (ІІ) Двохвалентному марганцю властиво виконувати катіонну функцію в сполуках різних класів, наприклад: MnO, [Mn (OH2) 6] 2+, Mn (OH) 2, MnCl2 та ін. Сполуки Mn (ІІІ) Оксид марганцю (ІІІ) Mn2О3 добувають прожарюванням піролюзиту MnО2·xH2O або нітрату Mn (ІІ) Сполуки Mn (IV) Чотиривалентний стан для марганцю термодинамічно не стабільний. Проте, в лужних середовищах стабільність Mn (IV) вища, ніж в кислому. Сполуки Mn (V) Для марганцю ступінь окиснення +5 не стійкий, проте утворення сполук марганцю (V) доведено, і деякі з них виділені в індивідуальному стані. Похідні Mn (V) стабілізуються в лужних середовищах, причому формою існування Mn (V) є оксоаніон - гіпоманганат-іон. Гіпоманганати добувають в результаті диспропорціонування Mn (IV), наприклад при розчиненні MnО2 в концентрованому КОН Сполуки Mn (VІ) Ступеню окиснення +6 відповідають оксоаніони MnO4 2-, які називаються манганат-іонами. Манганати являють собою єдиний реально існуючі сполуки Mn (VІ). Cполуки Mn (VII) Перманганат-іон - найважливіша сполука, яка містить Mn (VII). Вплив кислотного середовища на окисну активність водних розчинів перманганату можна прослідкувати на прикладі реакцій, в яких відновником виступає сірчистий газ. Окисні властивості перманганату посилюються, коли виникають умови його переходу в Mn2O7 - марганцевий ангідрид. Перманганат калію є сильним окислювачем. В залежності від pH розчину окисляє різні речовини, відновлюючись до з'єднань марганцю різного ступеня окислення. У кислому середовищі - до з'єднань марганцю (II), в нейтральній - до з'єднань марганцю (IV), в сильно лужному - до з'єднань марганцю (VI). Приклади реакцій наведені нижче (на прикладі взаємодії з сульфитом калію: · в кислому середовищі: 2KMnO4 + 5K2SO3 + 3H2SO4 → 6K2SO4 + 2MnSO4 + 3H2O; · в нейтральному середовищі: 2KMnO4 + 3K2SO3 + H2O → 3K2SO4 + 2MnO2 + 2KOH; · у лужному середовищі: 2KMnO4 + K2SO3 + 2KOH → K2SO4 + 2K2MnO4 + H2O; · у лужному середовищі на холоді: KMnO4 + K2SO3 + KOH → K 2SO4 + K3MnO4 + H2O.
Однак треба зазначити, що остання реакція (у лужному середовищі) йде за вказаною схемою тільки при недоліку відновника і високої концентрації лугу, яка забезпечує уповільнення гідролізу манганата калію. Вопрос 2билета Добування галогенів. Фтор добувають, пропускаючи електричний струм крізь розплавленні фториди, наприклад CaF2, KHF2. Хлор добувають в промисловості електролізом водних розчинів NaCl i KCl. (2NaCl+2H2O електроліз 2NaOH+Cl2↑+H2↑) У лабораторних умовах хлор можна добути, діючи концентрованою хлоридною кислотою на MnO2 або KМnO4. (4HCl+MnO2→MnCl2+Cl2↑+8H2O) Бром і йод можна добути аналогічно хлору окисленням HBr i HJ різними окислювачами. У промисловості бром і йод одержують із бромідів, діючи на їхні розчини хлором. (2KBr+Cl2→2KCl+Br2) (2KJ+CL2→2KCl+J2)бром добувають в основному з підземних бурових вод, а також з “ропи” (насиченого розчину) деяких солених озер. Основним джерелом добування йоду є підземні бурові води. Фізичні властивості. Фтор – газ світло-зеленого кольору і дуже отруйний (ρ = 1,11 г/см3). Фтор не може бути розчинений у воді через те, що він взаємодіє з нею. Хлор – газ жовто-зеленого кольору з різким, неприємним запахом. Хлор тяжчий за повітря, розчинний у воді (в 1 V води 2 V хлору), утворює хлорну воду Cl2аg. (ρ = 1,568 г/см3). Бром – рідина червоно-бурого забарвлення з неприємним запахом, у воді розчиняється погано, утворюючи бромну воду Br2 аg. Розчиняється в органічних розчинниках – бензолі, хлороформі. Якщо до бромної води додати бензолу і добре збовтати, то після розшарування рідин можна помітити, як бензол з Br2 забарвлюється в яскраво-оранжевий колір. Це пояснюється тим, що бром краще розчиняється у бензолі, ніж у воді. Бром тяжчий від води (ρ = 3,12 г/см3). Йод – кристалічна речовина, темно-сірого кольору, у парах – фіолетового. При нагріванні він з твердого стану зразу переходить в рідкий стан (сублімація). Йод погано розчиняється у воді (світло-жовта йодна вода), але добре розчиняється у спирту. Це використовують для приготування 5–10% розчину йоду в спирту (йодна настойка). Йод дуже добре розчиняється в розчині власних солей, наприклад в розчині калію йодиу. Цей розчин називається розчином Люголя, застосовується в медичній практиці Вопрос 2 билета За поширеністю у природі ферум посідає друге місце серед металів (після алюмінію). На нього припадає 5,10 % маси земної кори. За вмістом у земній корі ферум посідає 4-е місце. Зустрічається він виключно у вигляді сполук. Вільне залізо знаходять лише в метеоритах.Ферум — поширений елемент метеоритної речовини: в кам'яних метеоритах міститься до 25 %, а в залізних 90,85 мас.% Fe. Космічна поширеність заліза близька до його вмісту в фотосфері Сонця — 627 г/т. Частка феруму в речовині Землі досить велика — 38,8 %. Найбідніша на ферум поверхня Землі.Найважливішими природними сполуками феруму, що мають промислове значення, є магнітний залізняк Fe3O4, червоний залізняк Fe2O3, бурий залізняк Fe2O3 · nH2O та пірит FeS2. Оксиди феруму служать рудами, з яких добувають залізо, а пірит — сировиною для сульфатно-кислотного виробництва.Поширеність феруму в гірських породах (% за масою): ультраосновні — 9,85; основні — 8,56; середні — 5,85; кислі — 2,70; лужні — 3,60; осадові — 3,33. Відомо понад 300 мінералів, що містять ферум: оксиди, сульфіди, силікати, фосфати, карбонати та ін.Найважливіші мінерали феруму: гематит Fe2O3 (70 % Fe), магнетит Fe3O4 (72,4 % Fe), ґетит FeOOH (62,9 % Fe), лепідокрокіт FeO(OH) (62,9 % Fe), лімоніт — суміш гідрооксидів Fe з SiO2 та ін. речовинами (40-62 % Fe), сидерит FeCO3 (48,2 % Fe), ільменіт FeTiO3 (36,8 % Fe), шамозит (34-42 % FeO), вівіаніт (43,0 % FeO), скородит (34,6 % Fe2О3), ярозит (47,9 % Fe2О3) та ін.Багаті родовища магнітного залізняка зосереджені на Уралі поблизу м. Магнітогорська та в Курській області (так звана Курська магнітна аномалія). Родовища червоного залізняка є в Україні поблизу м. Кривий Ріг. Родовища бурого Билет 4 Хлор безпосередньо не сполучається з киснем. Тому його оксигенові сполуки добувають непрямим способом. У оксигенових сполуках хлор виявляє позитивний ступінь окиснення. Більшість бінарних сполук Хлору з оксигеном за звичайних умов – дуже нестійкі речовини, які розкладаються з вибухом. З киснем хлор утворює кілька оксидів – Cl2O, ClO2, Cl2O6 та Cl2O7, яким відповідають певні кислоти. Хлор (I) оксид Cl2O утворюється, якщо свіжоосаджений сухий гідрарирум (II) оксид взаємодіє з хлором: HgO + 2Cl2 = HgCl2 + Cl2O За звичайних умов Cl2O – жовто-бурий газ, який легко зріджується у червоно-буру рідину з температурою кипіння +2°С. Яка у рідкому, так і в твердому стані Cl2O розкладається з вибухом на хлор і кисень. При взаємодії з водою утворює гіпохлориту кислоту. Гіпохлоритна кислота HclO – одноосновна кислота, відома лише у розчині, в якому спостерігається рівновага: Cl2O + H2O «2HClO «2H+ + 2ClO- Гіпохлоритна кислота – дуже слабка кислота і витісняється з її солей навіть карбонатною кислотою. У розчині розкладається за одним з трьох рівнянь: HClO = HCl +O; 2HClO=Cl 2O +H2O; 3HClO = HClO + 2HCl. Гіпохлоритна кислота – сильний окисник, який застосовується в органічному синтезі, в процесах дезинфекції, вибілювання тощо. Солі гіпохлоритної кислоти – гіпохлорити – у розчині малостійкі і гідролізують. Їх добувають пропусканням хлору крізь холодний розчин лугу: 2KOH + Cl2 = KCl + KClO + H2O Розчин, що містить суміш солей лужних металів хлоридної і гіпохлоритної кислот, називається жавелевою водою і застосовується для вибілювання тканин, паперу тощо. Ці властивості жавелевої води зумовлені тим, що калій гіпохлорит легко розкладається під дією карбон (V) оксиду повітря з виділенням гіпохлоритної кислоти: KClO + CO2 + H2O = KHCO3 + HClO При пропусканні хлору крізь вологе вапно утворюється хлорне вапно, яке є сумішшю гіпохлориту, хлориду і гідроксиду кальцію. Внаслідок нагрівання концентрованого розчину хлорного вапна при наявності солей кобальту (каталізатора) і на сонячному світлі розкладання його відбувається з утворенням кальцій-хлориду та кисню. Якщо діяти на хлорне вапно хлоридною кислотою, то виділяється хлор: Ca(OCl)2 + 4HCl = CaCl2 + 2Cl2 + 2H2O Кількість хлору, що виділяється при взаємодії з кислотою (“активний хлор”), є умовною характеристикою окислювальної здатності хлорного вапна. Хлорне вапно як сильний окисник використовують для дегазації, дезинфекції, вибілювання тканин, паперу. Сполуки Хлору (III) і (IV) Хлор (IV) оксид ClO2 утворюється при нагріванні до 60°С вологої суміші KСlO3 і оксалатної кислоти за рівнянням: 2KСlO3 + H2C2O4 = 2ClO2 + K2CO3 + CO2 +H2O За звичайних умов ClO2 – жовто-зелений газ. Хлор (IV) оксид при взаємодії з водою утворює дві кислоти, а з лугом – дві солі: 2ClO2 + H2O = HClO2 + HClO3; 4ClO2 + 2Ca(OH)2 = Ca(ClO3)2 + Ca(ClO2)2 + 2H2O Хлорит на кислота HClO2 – одноосновна кислота існує лише в розбавлених розчинах. Утворюється при взаємодії її і барієвої солі з розбавленою сірчаною кислотою за рівнянням: Ba(ClO2)2 + H2SO4 = BaSO4¯ + 2HClO2 Водні розчини хлоритної кислоти поступово розкладаються з утворенням хлоридної і хлоратної HClO3 кислот. Практичного значення ця кислота немає. Солі її – хлорити – добувають при взаємодії Хлор (IV) оксиду з гідроксидами лужних, лужноземельних металів та їх пероксидами. Хлорити, як правило, добре розчиняються у воді, гідролізують. Хлорити у кислому середовищі виявляють сильні окислювальні властивості. Більш сильні окисники (Cl2, KMnO4 тощо) окислюють кислоту та її солі до хлоратної кислоти і до хлоратів. Хлорат на кислота HClO3 утворюється внаслідок взаємодії еквівалентних кількостей сульфатної кислоти з гарячим розчином солі Ba(ClO3)2. Кислота HClO3 – сильна одноосновна кислота – відома лише у розчині. Випарюванням водних розчинів кислоти у вакуумі можна підвищити їх концентрацію до 30-40 %. Органічні і неорганічні відновники відновляють кислоту, як правило, до хлоридної. Солі хлоратної кислоти називаються хлоратами. Найважливішою з них є калій-хлорат. Його добувають пропусканням хлору в гарячий концентрований розчин калію гідроксиду: 6KOH + 3Cl2 = 5KCl + KclO3 + 3H2O У промисловості хлорат калій (бертолетову сіль) добувають електролізом гарячого розчину калій хлориду або хлоруванням при 70-80°С гашеного вапна при наявності калій хлориду. Калій хлорат погано розчинний у воді, при нагріванні приблизно до 200°С при наявності MnO2 розкладається на кисень і калій хлорит. З різними горючими речовинами (сіркою, вугіллям, фосфором, органічними речовинами) калій хлорат утворює суміші, які вибухають при ударі. На цьому грунтується застосування його у артилерійській справі для виготовлення запалів, займистих та вибухових речовин. У хімічних лабораторіях калій хлорат використовують для добування кисню, як окисник (при сплавлянні), а також у медицині як слабкий дезинфікуючий засіб. При обережному нагріванні калій хлорату без каталізатора реакція відбувається за рівнянням: 4KClO3 = 3KClO4 + KCl При взаємодії солі KClO4 з сульфатною кислотою утворюється перхлоратна кислота. Перхлоратна кислота HClO4 – найстійкіша з окисно-місних кислот хлору. Безводна кислота – рухлива рідина, малостійка і при зберіганні іноді вибухає. Її концентровані водні розчини мають оліїсту консистенцію, концентрована (72 % – ий розчин) кислота димить на повітрі, досить гігроскопічна, стійка, не розкладається під дією світла. Перхлоратна кислота застосовується для витіснення більш летких кислот з їхніх солей і добування хлоратів, які використовують як детонатор. Вона є складовою частиною твердого ракетного палива. Концентровану хлоратну кислоту широко використовують для окиснення органічних речовин, розкладання руд і мінералів при їх аналізі, розчинення сталей, кількісного визначення калію і рубідію, як осушувач. Перхлоратна кислота утворює солі (перхлорати) майже з усіма металами. Ці солі добре розчиняються у воді і органічних розчинниках. До поганорозчинних у воді солей належать: KClO4, RbClO4, СsClO4 тощо. Безводна перхлоратна кислота і її солі дуже сильні окисники; однак для водних розчинів перхлоратів окислювальні властивості не характерні. Хлор (VI) оксид Cl2O6(ClO3) утворюється як побічний продукт при термічному розкладі перхлоратної кислоти. При кімнатній температурі Cl2O6 – рідина темно-бурого кольору, що димить на повітрі і при -78° С твердне. З водою оксид реагує, утворюючи дві кислоти, а з лугом – дві солі: Cl2O6 + 2KOH = KClO3 + KClO4 + H2O Хлор (VII) оксид Cl2O7 утворюється при нагріванні безводної перхлоратної кислоти з водовідбірними речовинами (P2O5, олеум тощо): 2HClO4 + P2O5 = 2HPO3 + Cl2O7 За звичайних умов хлор (VII) оксид є оліїстою рідиною з температурою кипіння 83° С; речовина нестійка і при ударі вибухає. З водою Cl2O7 не змішується, проте розчинення, що відбувається на поверхні краплин, призводить до утворення перхлоратної кислоти. Висновки Як бачимо, хімія оксигеновмісних сполук Хлору дуже різноманітна і цікава.Здатність Хлору утворювати таку велику кількість сполук з Оксигеном пояснюється будовою атома цього елемента.Атом Хлору на зовнішньому енергетичному рівні містить вільні d-орбіталі,на які під час збудження атома можуть переходити розпаровані електрони s-орбіталей. Тому у своїх сполуках з Оксигеном Хлор проявляє такий широкий спектр ступенів окислення: +1,+3,+4,+5,+6,+7. Порівнюючи оксигеновмісні кислоти хлору за окиснювальними властивостями і силою, можна зробити висновок: зі збільшенням ступеня окиснення Хлору сила кислоти зростає, а окиснювальна здатність зменшується
Елементи ІІ В підгрупи Властивості елементів та їх простих речовин: Хімічна активність зменшується із збільшенням атомної маси (а у головній підгрупі -навпаки). Хороші комплексоутворювачі.
Zn [Ar]3d104s2 Cd [Kr]4d105s2 Hg [Xe]4f145d106s2 Знаходження в природі Цинк зустрічається переважно у вигляді сульфідів (вюрцит ZnS), а також у поліметалевих рудах. Кадмій є супутником Цинку у його рудах. Гідраргірумутворює червоний мінерал кіновар HgS, відома і самородна ртуть. Метали Фізичні властивості: цинк- метал сріблясто-білого кольору; кадмій - білий, блискучий, м'який, ковкий метал; ртуть - сріблисто-білий, блискучий, єдиний рідкий при кімнатній температурі метал, має низьку електропровідність (вона складає 1,7 % від електропровідності срібла) і великим коефіцієнтом термічного розширення. Хімічні властивості Взаємодія з неметалами Взаємодіють з галогенами, утворюючи солі: Hg + І2 = HgІ2, Zn + Cl2 = ZnCl2. З киснем утворюють оксиди, реагують з сіркою, селеном, телуром: 2Zn + O2 = 2ZnO. Взаємодія з кислотами Нормальний окислювально-відновний потенціал Цинку у кислому середовищі системи Zn2+ / Zn дорівнює -0,76 В, а в лужному середовищі системи Zn22- / Zn дорівнює -1,22 В. Тому цинк розчиняється в розведених кислотах і лугах Zn + 2НCl > ZnCl2 + H2 Zn + H2SO4(розв.) > ZnSO4 + H2 Zn + 2NaOH + 2H2O > Na2[Zn(OH)4] + H2 Кадмій дуже мало розчиняється в кислотах, що не окисляють, добре розчиняється в розведеній HNO3 (нормальний потенціал Cd / Cd2+ = -0,40 В). Ртуть не розчиняється в соляній і розведеній сірчаній кислотах (у ряді напруг металів Hg знаходиться після Н; нормальний потенціал Hg / Hg2+ = +0,85 В). Ртуть легко розчиняється в концентрованій азотній кислоті - утвориться нітрат ртуті (II): Hg + 4HNO3 Hg(NO3)2 + 2NO2 + 2H2O Взаємодія з водою Ртуть використовують у термометрах, випрямлячах високої потужності. Солі Гідраргіруму застосовують у сільському господарстві для протравлювання посівного насіння. Нерозчинні солі є основою мазей для лікування шкірних хвороб, раніше їх використовували для лікування сифілісу. Природний мінерал кіновар - червона фарба. Сполуки Гідраргіруму токсичні. Ртуть з багатьма металами дає сплави (амальгами) (екзотермічне утворення). Пари і сполуки надзвичайно отруйні (накопичуються в організмі). Б5 1. до елементыв 6а групи належать халькогени: O, S, Se, Te, Po. У них э однаковий зовнышный рывень ns2np4. На відміну від кисню сірка, селен, телур і полоній можуть проявляти валентності не тільки 2, а й 4 та 6. Як і кисень, всі інші халкогени у сполуках з металами й воднем проявляють ступінь окиснення -2, оскільки до заповнення зовнішньої електронної оболонки їхніх атомів бракує два електрони.Для кисню відомі тільки дві алотропні видозміни: О2 та О3. Оскільки атоми сірки, селену і телуру при збудженні можуть мати до шести неспарених електронів, вони мають більше двох алотропних видозмін.При переході від сірки до полонію радіуси атомів збільшуються і зменьшуються їхні електронегативності та послаблюється здатність проявляти негативні ступені окислення. За звичайних умох сірка, селен, телур і полоній – тверді, крихкі речовини з молекулярною (сірка та селен) або металічною (телур і полоній) просторовивими ґратками. Сірка – типовий діелектрик. За своїм блиском телур і полоній найбільш схожі з металами.Сірка, селен і телур стійки на повітрі за звичайних умов і не розчиняються у воді. У хімічних реакціях вони ведуть себе як неметали, здатні сполучатись з металами з утворенням халькогенідів. Лужні метали з халькогенами сполучаються при кімнатній температурі, а інші – при нагріванні. 2. кристалічні ґратки У кристалічних речовинах атоми, молекули, йони розміщуються в певному порядку, утворюючи кристалічні ґратки. Розрізняють атомні, молекулярні, йонні та металічні кристалічні ґратки. Йонні кристалічні ґратки. Типовим представником сполук з йонним типом кристалічних ґраток є натрій хлорид NaCl. Його кристалічні ґратки утворені йонами Натрію Na+ та йонами Хлору Сl-, які почергово розміщуються у вузлах ґраток. Иони утримуються один з одним силами притягання, і кристал солі є ніби єдиним цілим. Атомні кристалічні ґратки. У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Такі кристалічні ґратки має алмаз. У його кристалі кожний атом Карбону сполучений ковалентними зв'язками з чотирма сусідніми атомами Карбону, тобто утворює чотири спільні електронні пари. Ось чому можна говорити, що Карбон — чотиривалентний елемент. Молекулярні кристалічні ґратки. У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Наприклад, у вузлах кристалічних ґраток йоду містяться молекули йоду І2. Сили міжмолекулярної взаємодії, так звані сили Ван-дер-Ваальса, значно слабкіші за сили ковалентного зв'язку. Тому речовини з молекулярними ґратками мають невелику твердість, вони легкоплавкі і леткі. До таких речовин належать, наприклад, йод, нафтален, бром, вода, спирт, хлор, амоніак NH3, метан СН4. Б6 2.Алотропія— явище, коли хімічний елемент існує у вигляді двох або кількох простих речовин. кисень O2 і озон O3 є алотропічними видозмінами елементу оксигену. Озон - хімічно-активний газ синього кольору з різким запахом, сильний окиснювач. При великих концентраціях розкладається з вибухом. Утворюється з кисню при електричному розряді. Використовується у хімічному синтезі, для стерилізації води, для дезинфекції й дезодорації повітря, вибілювання тканин, паперу, мінеральних масел тощо. Бактерицидний засіб. Використовують в медицині для лікування профілактики багатьох захворювань(озонотерапія). Кисень - хімічно активний неметал, є найлегшим елементом з групи халькогенами. Проста речовина кисень при нормальних умовах - газ без кольору, смаку і запаху, найпоширеніший на Землі. Добування: нагріванням перманганату калію: 2KMnO 4 → K2 MnO4 + MnO2 + O 2↑ також використовують реакцію каталітичного розкладання пероксиду водню Н2О2: 2Н2О2→2Н2О+О2↑, каталітичним розкладанням хлорату калію (бертолетової солі): 2KClO3 → 2KCl + 3O2↑. Сильний окислювач, взаємодіє практично з усіма елементами, утворюючи оксиди. Кисень утворює пероксиди зі ступенем окислення -1. Наприклад, пероксиди виходять при згоранні лужних металів в кисні. При охолодженні полум'я палаючого водню льодом, поряд з водою, утворюється перекис водню. Надпероксід мають ступінь окислення -1 / 2, то є один електрон на два атоми кисню. Отримують взаємодією пероксидів з киснем при підвищених тиску і температурі: Na2O2+O2=2NaO2. Б7 1 Окси́д — бінарна сполука, до складу якої входить Оксиген. Крім нормальних оксидів оксиген може утворювати й інші бінарні сполуки: складні оксиди, подвійні оксиди, вищий оксид пероксиди тощо. Якщо хімічний елемент проявляє сталу валентність і з киснем утворює тільки один оксид, то його називають просто оксидом цього елементу. Н-д: K2O — оксид калію. Оксиди з змінною валентністю елементів записуються з додаванням валентності елемента. Н-д: CO2 — оксид карбону (IV). Оксиди металів являють собою кристалічні речовини. Оксиди неметалів — це, навпаки, переважно легкі речовини і гази. Оксиди поділяються: Основні оксиди - це оксиди, яким відповідають основи: Na2O, CaO, MgO, K2O. Декотрі оксиди взаємодіють з водою з основ:CaO + H2O → Ca(OH)2 кислотні оксиди: СО2, SО2. Амфотерні:Оксид цинку;Оксид хрому (III);Оксид алюмінію;Оксид свинцю (II); При взаємодії з кислотними і амфотерними оксидами утворюють солі: СаО + СО2 = СаСО3…Кислотні оксиди називають ангідридами вказуючи цим, що їх можна одержати з кислот, віднімаючи від них елементи води. Деякі кислотні оксиди взаємодіють з водою, утворюючи відповідні гідроксиди, тобто кислоти. SiO2 практично не розчинний у воді, однак він нейтралізує основи, тому є кислотним оксидом 2NaOH + SiO2 →сплавлення Na2SiO3 + H2O Сульфітна кислота SO2 — безбарвний газ, з різким задушливим запахом. Він важчий від повітря більше ніж у два рази. При охолодженні до —10 °С діоксид сірки скраплюється в безбарвну прозору рідину. В залежності від умов діоксид сірки може бути відновником або окисником. Більш різко в нього виражені відновні властивості. При взаємодії з окисниками SO2 виявляє відновні властивості. SО2 + I2 + H2O = H2SО4+2HІ Навпаки, при взаємодії з дуже сильними відновниками він виявляє окиснювальні властивості.Наприклад: SO2+2H2S=3S↑+2H2O Сульфітний газ утворюється при спалюванні сірки в повітрі або в кисні:S+O2=SO2 В промисловості горіння піриту відбувається за реакцією: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑. як побічний продукт у кольоровій металургії при випалюванні сульфідних руд, наприклад цинкової обманки: 2ZnS+3O2=2ZnO+2SO2↑ H2SO3-нестійка кислота, що утворюється при розчинені діоксиду сірки у воді. Існує лише у водному розчині, і тому не виділена в чистому вигляді. Слабка двухосновна кислота, існує тільки у водному розчині, дуже нестійка. Розчиняючись у воді, сульфітний ангідрид поступово взаємодіє з водою, утворюючи сульфітну кислоту: SO2 + H2O = H2SO3.. Утворює два ряди солей: середні — сульфіти і кислі — бісульфіту. Сірчиста кислота та її солі є відновниками. При взаємодії з ще сильнішими відновниками сірчиста кислота грає роль окиснювача: H2SO3+ H2S= S+H2O..При взаємодії з хлором вона легко відновлює його до хлороводневої кислоти, а сама окиснюється до сульфатної кислоти: H2SO3+ СІ2+Н2О= H2SO4+ 2НСІ. Сірчиста кислота та її солі застосовуються як відновники, для вибілювання вовни, шовку та інших матеріалів, які не витримують відбілювання за допомогою сильних окисників (хлору). Сірчиста кислота застосовується при консервації ягід та овочів. Білет 8 1.Основа —електроліти, які у водному розчині дисоціюють з утворенням катіонів металу і аніонів ОН-. NaOH = Na+ + OH- Основи при взаємодії з кислотами і ангідридами, а також з амфотерними оксидами утворюють солі, а між собою не взаємодіють. Cu(OH)2 + 2HCl = CuCl2 + 2H2O; Ca(OH)2 + CO2 = CaCO3 + H2О; 2NaOH + ZnO = Na2ZnO2 + H2O. Основи називають звичайно гідроксидами відповідних металів. NaOH — гідроксид натрію, Ba(OH)2 — гідроксид барію. Якщо ж метал має змінну валентність і утворює кілька гідроксидів то ставлять префікси з грецьких числівників, які показують кількість гідроксильних груп: Cu(OH) — моногідроксид міді, Cu(OH)2 — дигідроксид міді, Fe(OH)3 — тригідроксид заліза. Гідроксид натрію NaOH називається їдким натром, гідроксид калію KOH — їдким калі, гідроксид кальцію Ca(OH)2 — гашеним вапном. Властивості: Основи є твердими речовини. Деякі з них, зокрема NaOH і KOH, у термічному відношенні досить стійкі: їх можна нагрівати до температури плавлення і навіть кипіння, і вони не розкладаються. Проте більшість основ нестійкі і при нагріванні легко розкладаються з утворенням оксидів і виділенням води. Ca(OH)2 = CaO + H2O Більшість основ нерозчинні у воді. Добре розчинними є тільки луги. Серед лугів практично найбільш вживаними є NaOH, KOH, Ca(OH)2 і Ba(OH)2. У лужному середовищі фіолетовий колір лакмусу змінюється на синій, метилоранжу — на ясно-жовтий, а фенолфталеїн стає фіолетовим. Лужні властивості розчинів основ обумовлюються наявністю в розчині гідроксильних іонів. Добування: 1.сполученням основних оксидів з водою. Na2O + H2O = 2NaOH 2.Взаємодією їдких лугів, з розчинами солей: CuSO4 + 2KOH = Cu(OH)2 ↓ + K2SO4 3.Взаємодією найактивніших металів (K, Na, Ca, Ba) з водою: 2Na + 2H2O = 2NaOH + H2 ↑ 2.H2S. Це безбарвний, дуже отруйний, горючий газ з характерним неприємним запахом тухлих яєць, Цей газ утворюється в результаті вулканічної активності, входить до складу природного газу, і деяких вод. Людське тіло виробляє невелика кількість H2S в якості сигнальної молекули. Сірководень трохи важчий за повітря, суміш H2S і повітря — вибухонебезпечна. горить синім полум'ям, з утвореннмSO2 і води. відновник.При високій температурі або в присутності каталізатора, сірководень розкладається на елементарну сірку та воду. Добування: Б9 КИСЛОТИ. Кислоти – це сполуки які складаються з кислотного залишку і атомів гідрогену. Поділяються: на оксигено- і безскесигеновмісні; одно-, дво-, три-, чотири-, п’яти-, шестиосновні. Взаємодіють з основами, металами, солями, основними оксидами. Добування: 1.взаємодія кислотного оксиду з водою, 2. Дією іншої кислоти на відновлювану сіль, 3.безкисневі кислти добувають синтезом з водню і неметалу з наступним розчиненням водневої сполуки у воді. Деякі поширені кислоти можуть в різних джерелах мати різні назви: наприклад, водний розчин HCl може називатися соляної, хлороводородной, хлористоводневою кислотою. Номенклатура кислот. Назви кисневмісних кислот утворюють з назв кислотоутворюючого елемента та слова кислота. При цьому назва кислоти, в якій елемент виявляє вищий ступінь окислення, має закінчення -на, -ієва(ева), -ова. Із зниженням ступеня окислення кислотоутворюючого елемента закінчення кислот змінюються в такій послідовності: -нувата, -иста, -нуватиста. Якщо елемент утворює дві кислоти, то назва з нижчим ступенем окислення елемента має закінчення -иста. SO2 безбарвний газ, з різким задушливим запахом. Сірка в ньому позитивно чотиривалентна. Тому атом сірки в молекулі SO2 може або віддавати ще два електрони, або приєднувати чотири або шість електронів. Отже, в залежності від умов діоксид сірки може бути відновником або окисником. Більш різко в нього виріажені відновні властивості. При взаємодії з окисниками SO2 виявляє відновні властивості. Наприклад: S4+О2 + I02 + H2O = H2S6+О4 + 2HІ. При взаємодії з дуже сильними відновниками він виявляє окиснювальні властивості: S4+O2 + 2H2S2- = 3S0 ↑ + 2H2O. - хімічна сполука, нестійка кислота, що утворюється при розчинені діоксиду сірки у воді. Існує лише у водному розчині, і тому не виділена в чистому вигляді. Б10 1.СОЛІ - о рганічні речовини, утворені металом і кислотним залишком. Бувають: звичайна(Ме+кис.залишок), кисла(зявляється Н), основна(зявляється ОН MgOHCl), подвійна(два метали і кисл.залишок KAl(SO4)2), комплексні (комплексні іони K4[Fe(CN)6]) взаємодіють з кислотами, основами, металами, солями. Назви середніх солей утворюються з двох слів: назви металу у називному відмінку та назви аніона кислоти, наприклад: СаSО4 – кальцій сульфат; КСl – калій хлор. H2SO4 - Безбарвна масляниста,дуже в'язка і гігроскопічна рідина. Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються один або два аніони гідрогену на катіони металів. Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількістю виробництва. Вона в основному використовується для виробництва добрив і інших неорганічних кислот. В основному використовуються водні розчини цієї кислоти. Добування: 1.випалювання в «киплячому шарі»(циклон, електрофільтр, сушильна башта, теплообмінник) 2.Контактний апарт, 3.Вбирна башта. Лакмус і метил оранж – рожевий. Реагує з солями, металами, оксидами. Концентрована звуглює орг..речовини. застосування: як проносне. При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни. В11 1.періодичний закон - властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів. 2. сульфати. Сульфа́ти — солі сірчаної кислоти — H2SO4.Сульфатна кислота утворює два ряди солей: нормальні солі, які називають сульфатами, і кислі, які називають гідрогенсульфатами. Сульфати у більшості добре розчинні. До малорозчинних належать сульфат кальцію CaSO4 і сульфат свинцю PbSO4. Нерозчинним у воді є сульфат барію BaSO4. Багато сульфатів широко застосовується у практиці, наприклад BaSO4, CaSO4 і CuSO4. Сульфати міді та заліза іноді називають купоросами. Б12 1. Теорія Резерфорда: кожний електрон обертається навколо атомного ядра, причому сила притягання ядра зрівноважується відцентрованою силою, яка виникає при обертанні електрона. Теорія Бора: проминиста енергія виділяється і вбирається певними порціями – квантами. 2.азот і фосфор. У вільному стані фосфор буває в кількох алотропічних модифікаціях. Найбільше значення мають так звані білий і червоний фосфор. Білий фосфор являє собою безбарвну воскоподібну речовину з жовтуватим відтінком, через що його називають також жовтим фосфором. Білий фосфор — легкозаймиста речовина. Червоний фосфор являє собою порошкоподібну речовину червоно-бурого кольору, не отруйний і в сірковуглеці не розчиняється. При охолодженні пари фосфору переходять у білий фосфор. Чорний фосфор – речовина, схожа на графіт, має шарувату будову. Він масний на дотик, з металічним блиском, виявляє властивості напівпровідників. Реагую з киснем, неметалами, з багатьма металами, утворюючи фосфіди: 2P + 3Ca = Ca3P2. при дії на фосфід кальцію розведеної хлоридної кислоти утворюється фосфін PH3. Азот |


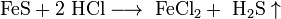 ..
..  Хімічні властивості: при достатньому доступі кисню сірководень горить на повітрі з утворенням двоокису сірки і водяної пари:
Хімічні властивості: при достатньому доступі кисню сірководень горить на повітрі з утворенням двоокису сірки і водяної пари:  При недостатньому доступі кисню, згоряє з утворенням води і виділенням вільної сірки:
При недостатньому доступі кисню, згоряє з утворенням води і виділенням вільної сірки:  У водному розчині сірководень легко окиснюється галогенами:
У водному розчині сірководень легко окиснюється галогенами:  Він діє як розслаблювач гладких м'язів і, як судинорозширювач, також бере активну участь в роботі мозку, де він збільшує реакцію рецепторів і полегшує довгострокове потенціювання, яке бере участь у формуванні пам'яті. Сірководень в наш час визнаний як потенційний захисник від серцево-судинних захворювань. Сірководень також бере участь в процесі 1 типу діабету. Бета-клітин підшлункової залози при цукровому діабеті.
Він діє як розслаблювач гладких м'язів і, як судинорозширювач, також бере активну участь в роботі мозку, де він збільшує реакцію рецепторів і полегшує довгострокове потенціювання, яке бере участь у формуванні пам'яті. Сірководень в наш час визнаний як потенційний захисник від серцево-судинних захворювань. Сірководень також бере участь в процесі 1 типу діабету. Бета-клітин підшлункової залози при цукровому діабеті.