
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Елементи-метали в Періодичній системіСодержание книги
Поиск на нашем сайте
Якщо в Періодичній системі провести діагональ від Берилію до Астату, то зліва внизу розміщуватимуться елементи-метали (до них же належать елементи побічних підгруп). Хімічні властивості металів Метали розрізняються між собою хімічною активністю, тобто здатністю вступати в хімічні реакції. Їх можна розташувати в ряд за зменшенням активності (див. таблицю). Металургія — це галузь промисловості, яка займається видобуванням металів із руд. Електрохімі́чний ряд напру́г, ряд активності — послідовність металів за ступенем легкості віддачі електронів при хімічних реакціях у водних розчинах солей. У цьому ряді найпоширеніші метали розташовуються в такому порядку: K, Na, Ba, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au. Електрохімічний ряд напруг показує:
Білет № 25 1)Охарактеризуйте окисно-відновні реакції,їх типи.Визначення коефіцієнтів у рівняннях окисно-відновних реакцій методом електронного балансу. О́кисно-відно́вна реа́кція — хімічна реакція, яка відбувається зі зміною ступеня окиснення атомів, що входять до складу реагентів, і реалізується перерозподілом електронів між атомом-окисником та атомом-відновником. Типи: - міжмолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в різних молекулах, наприклад: -внутрішньомолекулярні — реакції, в яких атоми, що відновлюються та окиснюються знаходяться в одній і тій ж самій молекулі, наприклад: -репропорціонування (компропорціонування) -диспропорціонування (самоокиснення-самовідновлення) - реакції, в яких атоми одного елементу перетворюються на речовину (речовини) зі змінною ступенів окиснення, наприклад: Окисно-відновна реакція між воднем та фтором: Поділяється на дві напівреакції: 1) Окиснення:
2) Відновлення:
Атоми та йони, які в даній реакції приєднують електрони є окисниками, а які віддають електрони -відновниками. Метод електронного балансу – це один з методів зрівнювання окислювально-відновних реакцій(ОВР).Полягає в тому щоб на підставі мір окислення розставити коефіцієнти в ОВР.Для правильного зрівнювання слід дотримуватися певної послідовності дій: Знайти окисник і відновник. Скласти для них схеми(напівреакції) переходів електронів, що відповідають цьому окислювально-відновному процесу. Зрівняти число відданих і прийнятих електронів в напівреакціях. Підсумувати нарізно ліві і праві частини напівреакцій. Розставити коефіцієнти в рівнянні окислювально відновної реакції. Приклад: Li + N2 = Li3N Li0 + N20 = Li3+1N−3 Li0 — 1e = Li+1 Отримуємо: 6Li0 — 6e = 6Li+1 N20 + 6e = 2N−320 + 6e = 2N−3 6Li + N2 = 2Li3N 2)Проаналізуйте поширення в природі,властивості,одержання і застосування лужних металів та їх сполук. Лужні метали - це елементи 1-ї групи періодичної таблиці хімічних елементів (по застарілої класифікації - елементи головної підгрупи I групи): літій Li, натрій Na, калій K, рубідій Rb, цезій Cs і францій Fr. При розчиненні лужних металів в воді утворюються розчинні гідроксиди, звані лугами. Лужні метали зустрічаються в природі у формі сполук, що містять однозарядні катіони. Багато мінералів містять у своєму складі метали головної підгрупи I групи. Фізичні властивості Лужні метали — м'які (натрій ріжеться ножем, як вершкове масло, інші трохи жорсткіші) метали від сріблисто-білого до сірого кольору з характерним блиском, що дуже швидко тьмяніють на повітрі. Легкоплавкі й рухливі. Агресивні, вибухонебезпечні (зберігаються в атмосфері інертного газу або під шаром гасу) Хімічні властивості: - Взаємодія з водою: - Взаємодія з киснем: -реагують із неметалами: 2Na + S = Na2S 2K + Br2 = 2KBr Отримання лужних металів: -Для отримання лужних металів використовують в основному електроліз розплавів їх галогенідів, найчастіше - хлоридів, що утворюють природні мінерали: -проводять електроліз розплавів їх гідроксидів: -Лужний метал може бути відновлений з відповідного хлориду або броміду кальцієм, магнієм, кремнієм та ін восстановителями при нагріванні під вакуумом до 600-900 C: Білет №26 1) Охарактеризуйте будову комплексних сполук.Типи хім..зв.в комплексних сполуках. Комплексні сполуки – це стійкі хім.сполуки,у вузлах кристалічної гратки яких,містяться складні частинки,що містять центральний атом або йон і оточуючи його молекули або йони. Будова КС: К3[Fe(CN)6]:зовнішня сфера,внутрішня сфера,ліганда,координаційне число,центральний атом(комплексоутворювач).В ролі комплексоутворювача виступають d – елементи.Координаційне число – це число зв’язків за допомогою яких,ліганди зв’язуються з комплексоутворювачем,воно залежить від природи комплексоутворювача і ліганд,із збільшенням ступеня окиснення центрального атома зростає і значення координаційного числа,яке переважно у 2 рази більше від валентності комплексоутворювача, і в більшості випадків має значення 2,4,6.Ліганди характеризує координаційна ємність або дентатність,що визначає кількість місць який займає ліганд у внутрішній координаційній сфері. Природа хім.зв.в К.С.:
2) Проаналізуйте знаходження в природі,добування металів ІІ А групи.Добування.Солі Магнію та лужноземельних металів: властивості та використання їх в медицині. ………. №27 2.Тве́рдість води́ — якщо вода містить значні кількості солей кальцію і магнію, то таку воду називають твердою, а коли цих солей зовсім немає, або вони містяться в незначних кількостях, то — м'якою.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 519; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.91.196 (0.008 с.) |

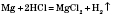
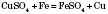




 рухаються до катода — негативно зарядженого електрода, а аніони
рухаються до катода — негативно зарядженого електрода, а аніони  — до анода — позитивно зарядженого електрода. На аноді відбувається процес окиснення, на катоді — відновлення. Металевий зв'язок. Зв'язок, який утвориться внаслідок взаємодії відносно вільних електронів з іонами металів, називаються металевим зв'язком. Цей тип зв'язку характерний для простих речовин- металів. Суть процесу утворення металевого зв'язку складається в наступному: атоми металів легко віддають валентні електрони і перетворюються в позитивні заряджені іони. Відносно вільні електрони, що відірвалися від атома, переміщаються між позитивними іонами металів. Між ними виникає металевий зв'язок, т. е. Електрони як би цементують позитивні іони кристалічних ґраток металів.
— до анода — позитивно зарядженого електрода. На аноді відбувається процес окиснення, на катоді — відновлення. Металевий зв'язок. Зв'язок, який утвориться внаслідок взаємодії відносно вільних електронів з іонами металів, називаються металевим зв'язком. Цей тип зв'язку характерний для простих речовин- металів. Суть процесу утворення металевого зв'язку складається в наступному: атоми металів легко віддають валентні електрони і перетворюються в позитивні заряджені іони. Відносно вільні електрони, що відірвалися від атома, переміщаються між позитивними іонами металів. Між ними виникає металевий зв'язок, т. е. Електрони як би цементують позитивні іони кристалічних ґраток металів.


