
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Цинк та кадмій - активні метали. Ртуть відноситься до мало активних металів, стійка на повітрі.Содержание книги
Поиск на нашем сайте
Взаємодія з неметалами Взаємодіють з галогенами, утворюючи солі: Hg + І2 = HgІ2, Zn + Cl2 = ZnCl2. З киснем утворюють оксиди, реагують з сіркою, селеном, телуром: 2Zn + O2 = 2ZnO. Цинк і кадмій реагують з фосфором при нагріванн 3Zn + 2Р Zn3Р2 Ртуть взаємодіє тільки з сіркою і галогенами Hg + S > HgS Hg + Br2 HgBr2 Взаємодія з кислотами Нормальний окислювально-відновний потенціал Цинку у кислому середовищі системи Zn2+ / Zn дорівнює -0,76 В, а в лужному середовищі системи Zn22- / Zn дорівнює -1,22 В. Тому цинк розчиняється в розведених кислотах і лугах Zn + 2НCl > ZnCl2 + H2 Zn + H2SO4(розв.) > ZnSO4 + H2 Zn + 2NaOH + 2H2O > Na2[Zn(OH)4] + H2 Кадмій дуже мало розчиняється в кислотах, що не окисляють, добре розчиняється в розведеній HNO3 (нормальний потенціал Cd / Cd2+ = -0,40 В). Ртуть не розчиняється в соляній і розведеній сірчаній кислотах (у ряді напруг металів Hg знаходиться після Н; нормальний потенціал Hg / Hg2+ = +0,85 В). Ртуть легко розчиняється в концентрованій азотній кислоті - утвориться нітрат ртуті (II): Hg + 4HNO3 Hg(NO3)2 + 2NO2 + 2H2O При розчиненні ртуті в розведеній азотній кислоті утвориться нітрат ртуті (I), 6Hg + 8HNO3 3Hg2(NO3)2 + 2NO + 4H2O При розчиненні ртуті в гарячій концентрованій сірчаній кислоті в залежності від надлишку ртуті чи кислоти утворюються солі одновалентної чи двовалентної ртуті: Hg + 2H2SO4 HgSO4 + SO2 + 2H2O 2Hg + 2H2SO4 Hg2SO4 + SO2 + 2H2O Ртуть розчиняється в царській горілці: 3Hg + 2HNO3 + 6HCl > 3HgCl2 + 2NO + 4H2O Взаємодія з водою Цинк не розкладає воду, тому що у водяному розчині він швидко покривається захисною плівкою оксиду, що охороняє його від корозії. Взаємодія з іншими сполуками Цинк - сильний відновник і витісняє менш активні метали (що розташовані праворуч у ряді напруг) з розчинів їхніх солей Zn + CuSO4> ZnSO4 + Cu Ртуть взаємодіє з солями менш активних металів: 2AgNO3+Hg = Hg(NO3)2+2Ag, та солями Гідроргіруму(ІІ) з утворенням солей Hg1+: HgCl2 + Hg = Hg2Cl2. Одержання металів. Цинк та кадмій добувають відновленням їх оксидів вуглецем: ZnO + C = Zn + CO, ртуть добувають випалюванням кіноварі: HgS + O2 = Hg + SO2. Сполуки. У сполуках Цинк та Кадмій виявляє тільки один ступінь окиснення +2, сполуки Цинку білого кольору. Іон Сd2+ - безбарвний. Гідраргірум виявляє ступені окиснення +2 та +1. Оксиди: Оксид цинку виявляє амфотерний характер, розчиняючись як у кислотах, так і в розчинах лугів ZnO + H2SO4> ZnSO4 + H2O ZnO + 2NaOH + H2O > Na2[Zn(OH)4]. Оксид кадмію СdО (коричневого кольору) виявляє основний характер і розчиняється тільки в кислотах: CdO + 2HCl > CdCl2 + H2O (CdO + 2H+> Cd2+ + H2O) Оксид гідраргіруму(II) HgО: червоний кристалічний чи жовтий аморфний порошок; погано розчинний у воді, розчин має слабко лужну реакцію; виявляєосновний характер. Одержання HgО Hg2(NO3)2 2HgO + 2NO2 2Hg(NO3)2 2HgO + 4NO2 + O2 Hg 2+ + 2OH- HgO + H2O HgО легко відновлюється; при нагріванні розкладається на ртуть і кисень. Реагує з кислотами з утворенням солей і води. Гідроксиди: Гідроксид цинку виявляє амфотерні властивості. Він нерозчинний у воді, але розчиняється в кислотах і лугах: Zn(OH)2 + 2HCl > ZnCl2 + 2H2O Zn(OH)2 + 2NaOH > Na2[Zn(OH)4] При нагріванні комплексний тетрагідроксицинкат-аніон дегідратується: [Zn(OH)4]2- ZnO22- + 2H2O Гідроксид кадмію Сd(ОН)2 (білого кольору) виявляє основний характер, розчиняючися тільки в кислотах: Cd(OH)2 + 2HCl > CdCl2 + 2H2O (Cd(OH)2 + 2H+> Cd 2+ + 2H2O) Солі: Іон Zn2+ є енергійним комплексоутворювачем (координаційне число 4). На відміну від гідроксиду алюмінію, гідроксид цинку розчиняється у водному розчині аміаку: Zn(OH)2 + 2NH3> [Zn(NH3)4](OH)2 Cd2+ є хорошим комплексоутворювачем (координаційне число 4). Гідроксид кадмію розчиняється у водному розчині аміаку: Cd(OH)2 + 4NH3> [Cd(NH3)4](OH)2 Для сполук Цинку характерне утворення катіонних та аніонних комплексів з координаційним числом 4, в тому числі і гідроксокомплексів: Zn(OH)2 + 2KOH = K2[Zn(OH)4], Zn(OH)2 + 4NH3 = [Zn(NH3)4] (OH)2, Zn(CN)2 + 2KCN = K2[Zn(CN)4]. Кадмій і Гідраргірум утворюють виключно аніонні комплекси з координаційним числом 4: Cd(CN)2 + 2KCN = K2[Cd(CN)4] HgІ2 + 2KІ = K2[HgІ4]. HgS (кіновар) - яскраво-червоний нерозчинний у воді порошок - утворюється по реакціям Hg + S > HgS; Hg2+ + S2-> HgS Галогеніди ртуті(II) одержують по реакціям Hg + Br2> HgBr2 При взаємодії HgI2 + 2KI > K2[HgI4] утворюється комплексна сіль -реактив Несслера, який використовується в якості дуже чутливого аналітичного реагенту для виявлення іона NH4+: 2[Hg4]2- + NH4+ + 4OH- > []+(коричневий осад) I->+ 7I- + 3H2O Сульфат та нітрат гідраргіруму(II)одержують розчиненням Hg чи HgО у концентрованих сірчаній чи азотній кислотах відповідно. Hg + 2H2SO4(гаряча,конц.) HgSO4 + SO2 + 2H2O HgО + H2SO4 HgSO4 + H2O 3Hg + 8HNO3(конц.) 3Hg(NO3)2 + 2NO + 4H2O HgО + 2HNO3 Hg(NO3)2 + H2O Більш активні метали легко витісняють ртуть з її солей: Cu+Hg(NO3)2> Cu(NO3)2+Hg Нітрат гідраргіруму(II) розкладається з утворенням металу: Hg(NO3)2Hg+2NO2+O2. Якісні реакції на елементи. При дії лугів на солі цинку випадає білий осад Zn(OH)2, розчинний у надлишку лугів та аміаку: Zn2+ + 2OH- = Zn(OH)2, Zn(OH)2 + 2KOH = K2[Zn(OH)4], Zn(OH)2 + 4NH3 = [Zn(NH3)4] (OH)2. При дії сульфідів на солі кадмію випадає оранжевий осад СdS, розчинний у кислотах: Cd2+ + S2- = CdS. При дії сірководню на солі Гідраргіруму(І) та Гідраргіруму(II) випадають чорні осади HgS та Hg2S, нерозчинні в кислотах: Hg22+ + H2S = Hg2S + H+, Hg2+ + H2S = HgS + 2H+. При дії на солі Гідраргіруму йодиду калію KІ випадають осади HgІ2 (червоний, розчинний в надлишку KІ) та Hg2І2 (жовтого кольору). Використання. Цинк використовують як відновник у гідрометалургії (Zn+CuSO4=Cu+ZnSO4), для анодного покриття чорних металів, як протектор, а також для одержання сплавів (ЦАМ, латуні). Оксид цинку ZnO - білий пігмент. Сульфатом цинку просочують деревину для захисту від грибків. Сполуки цинку застосовують як фунгіциди у сільському господарстві та медицині. Кадмій іде на анодне покриття чорних металів. Ртуть використовують у термометрах, випрямлячах високої потужності. Солі Гідраргіруму застосовують у сільському господарстві для протравлювання посівного насіння. Нерозчинні солі є основою мазей для лікування шкірних хвороб, раніше їх використовували для лікування сифілісу. Природний мінерал кіновар - червона фарба. Сполуки Гідраргіруму токсичні. Ртуть з багатьма металами дає сплави (амальгами) (екзотермічне утворення). Пари і сполуки надзвичайно отруйні (накопичуються в організмі). Б5 1. до елементыв 6а групи належать халькогени: O, S, Se, Te, Po. У них э однаковий зовнышный рывень ns2np4. На відміну від кисню сірка, селен, телур і полоній можуть проявляти валентності не тільки 2, а й 4 та 6. Як і кисень, всі інші халкогени у сполуках з металами й воднем проявляють ступінь окиснення -2, оскільки до заповнення зовнішньої електронної оболонки їхніх атомів бракує два електрони.Для кисню відомі тільки дві алотропні видозміни: О2 та О3. Оскільки атоми сірки, селену і телуру при збудженні можуть мати до шести неспарених електронів, вони мають більше двох алотропних видозмін.При переході від сірки до полонію радіуси атомів збільшуються і зменьшуються їхні електронегативності та послаблюється здатність проявляти негативні ступені окислення. За звичайних умох сірка, селен, телур і полоній – тверді, крихкі речовини з молекулярною (сірка та селен) або металічною (телур і полоній) просторовивими ґратками. Сірка – типовий діелектрик. За своїм блиском телур і полоній найбільш схожі з металами.Сірка, селен і телур стійки на повітрі за звичайних умов і не розчиняються у воді. У хімічних реакціях вони ведуть себе як неметали, здатні сполучатись з металами з утворенням халькогенідів. Лужні метали з халькогенами сполучаються при кімнатній температурі, а інші – при нагріванні. 2. кристалічні ґратки У кристалічних речовинах атоми, молекули, йони розміщуються в певному порядку, утворюючи кристалічні ґратки. Розрізняють атомні, молекулярні, йонні та металічні кристалічні ґратки. Йонні кристалічні ґратки. Типовим представником сполук з йонним типом кристалічних ґраток є натрій хлорид NaCl. Його кристалічні ґратки утворені йонами Натрію Na+ та йонами Хлору Сl-, які почергово розміщуються у вузлах ґраток. Иони утримуються один з одним силами притягання, і кристал солі є ніби єдиним цілим. Атомні кристалічні ґратки. У вузлах атомних кристалічних ґраток містяться окремі атоми, сполучені між собою ковалентними зв'язками. Такі кристалічні ґратки має алмаз. У його кристалі кожний атом Карбону сполучений ковалентними зв'язками з чотирма сусідніми атомами Карбону, тобто утворює чотири спільні електронні пари. Ось чому можна говорити, що Карбон — чотиривалентний елемент. Молекулярні кристалічні ґратки. У вузлах молекулярних кристалічних ґраток містяться молекули як неполярні, так і полярні. Наприклад, у вузлах кристалічних ґраток йоду містяться молекули йоду І2. Сили міжмолекулярної взаємодії, так звані сили Ван-дер-Ваальса, значно слабкіші за сили ковалентного зв'язку. Тому речовини з молекулярними ґратками мають невелику твердість, вони легкоплавкі і леткі. До таких речовин належать, наприклад, йод, нафтален, бром, вода, спирт, хлор, амоніак NH3, метан СН4. Б6 2.Алотропія— явище, коли хімічний елемент існує у вигляді двох або кількох простих речовин. кисень O2 і озон O3 є алотропічними видозмінами елементу оксигену. Озон - хімічно-активний газ синього кольору з різким запахом, сильний окиснювач. При великих концентраціях розкладається з вибухом. Утворюється з кисню при електричному розряді. Використовується у хімічному синтезі, для стерилізації води, для дезинфекції й дезодорації повітря, вибілювання тканин, паперу, мінеральних масел тощо. Бактерицидний засіб. Використовують в медицині для лікування профілактики багатьох захворювань(озонотерапія). Кисень - хімічно активний неметал, є найлегшим елементом з групи халькогенами. Проста речовина кисень при нормальних умовах - газ без кольору, смаку і запаху, найпоширеніший на Землі. Добування: нагріванням перманганату калію: 2KMnO 4 → K2 MnO4 + MnO2 + O 2↑ також використовують реакцію каталітичного розкладання пероксиду водню Н2О2: 2Н2О2→2Н2О+О2↑, каталітичним розкладанням хлорату калію (бертолетової солі): 2KClO3 → 2KCl + 3O2↑. Сильний окислювач, взаємодіє практично з усіма елементами, утворюючи оксиди. Кисень утворює пероксиди зі ступенем окислення -1. Наприклад, пероксиди виходять при згоранні лужних металів в кисні. При охолодженні полум'я палаючого водню льодом, поряд з водою, утворюється перекис водню. Надпероксід мають ступінь окислення -1 / 2, то є один електрон на два атоми кисню. Отримують взаємодією пероксидів з киснем при підвищених тиску і температурі: Na2O2+O2=2NaO2. Б7 1 Окси́д — бінарна сполука, до складу якої входить Оксиген. Крім нормальних оксидів оксиген може утворювати й інші бінарні сполуки: складні оксиди, подвійні оксиди, вищий оксид пероксиди тощо. Якщо хімічний елемент проявляє сталу валентність і з киснем утворює тільки один оксид, то його називають просто оксидом цього елементу. Н-д: K2O — оксид калію. Оксиди з змінною валентністю елементів записуються з додаванням валентності елемента. Н-д: CO2 — оксид карбону (IV). Оксиди металів являють собою кристалічні речовини. Оксиди неметалів — це, навпаки, переважно легкі речовини і гази. Оксиди поділяються: Основні оксиди - це оксиди, яким відповідають основи: Na2O, CaO, MgO, K2O. Декотрі оксиди взаємодіють з водою з основ:CaO + H2O → Ca(OH)2 кислотні оксиди: СО2, SО2. Амфотерні:Оксид цинку;Оксид хрому (III);Оксид алюмінію;Оксид свинцю (II); При взаємодії з кислотними і амфотерними оксидами утворюють солі: СаО + СО2 = СаСО3…Кислотні оксиди називають ангідридами вказуючи цим, що їх можна одержати з кислот, віднімаючи від них елементи води. Деякі кислотні оксиди взаємодіють з водою, утворюючи відповідні гідроксиди, тобто кислоти. SiO2 практично не розчинний у воді, однак він нейтралізує основи, тому є кислотним оксидом 2NaOH + SiO2 →сплавлення Na2SiO3 + H2O Сульфітна кислота SO2 — безбарвний газ, з різким задушливим запахом. Він важчий від повітря більше ніж у два рази. При охолодженні до —10 °С діоксид сірки скраплюється в безбарвну прозору рідину. В залежності від умов діоксид сірки може бути відновником або окисником. Більш різко в нього виражені відновні властивості. При взаємодії з окисниками SO2 виявляє відновні властивості. SО2 + I2 + H2O = H2SО4+2HІ Навпаки, при взаємодії з дуже сильними відновниками він виявляє окиснювальні властивості.Наприклад: SO2+2H2S=3S↑+2H2O Сульфітний газ утворюється при спалюванні сірки в повітрі або в кисні:S+O2=SO2 В промисловості горіння піриту відбувається за реакцією: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2↑. як побічний продукт у кольоровій металургії при випалюванні сульфідних руд, наприклад цинкової обманки: 2ZnS+3O2=2ZnO+2SO2↑ H2SO3-нестійка кислота, що утворюється при розчинені діоксиду сірки у воді. Існує лише у водному розчині, і тому не виділена в чистому вигляді. Слабка двухосновна кислота, існує тільки у водному розчині, дуже нестійка. Розчиняючись у воді, сульфітний ангідрид поступово взаємодіє з водою, утворюючи сульфітну кислоту: SO2 + H2O = H2SO3.. Утворює два ряди солей: середні — сульфіти і кислі — бісульфіту. Сірчиста кислота та її солі є відновниками. При взаємодії з ще сильнішими відновниками сірчиста кислота грає роль окиснювача: H2SO3+ H2S= S+H2O..При взаємодії з хлором вона легко відновлює його до хлороводневої кислоти, а сама окиснюється до сульфатної кислоти: H2SO3+ СІ2+Н2О= H2SO4+ 2НСІ. Сірчиста кислота та її солі застосовуються як відновники, для вибілювання вовни, шовку та інших матеріалів, які не витримують відбілювання за допомогою сильних окисників (хлору). Сірчиста кислота застосовується при консервації ягід та овочів. Білет 8 1.Основа —електроліти, які у водному розчині дисоціюють з утворенням катіонів металу і аніонів ОН-. NaOH = Na+ + OH- Основи при взаємодії з кислотами і ангідридами, а також з амфотерними оксидами утворюють солі, а між собою не взаємодіють. Cu(OH)2 + 2HCl = CuCl2 + 2H2O; Ca(OH)2 + CO2 = CaCO3 + H2О; 2NaOH + ZnO = Na2ZnO2 + H2O. Основи називають звичайно гідроксидами відповідних металів. NaOH — гідроксид натрію, Ba(OH)2 — гідроксид барію. Якщо ж метал має змінну валентність і утворює кілька гідроксидів то ставлять префікси з грецьких числівників, які показують кількість гідроксильних груп: Cu(OH) — моногідроксид міді, Cu(OH)2 — дигідроксид міді, Fe(OH)3 — тригідроксид заліза. Гідроксид натрію NaOH називається їдким натром, гідроксид калію KOH — їдким калі, гідроксид кальцію Ca(OH)2 — гашеним вапном. Властивості: Основи є твердими речовини. Деякі з них, зокрема NaOH і KOH, у термічному відношенні досить стійкі: їх можна нагрівати до температури плавлення і навіть кипіння, і вони не розкладаються. Проте більшість основ нестійкі і при нагріванні легко розкладаються з утворенням оксидів і виділенням води. Ca(OH)2 = CaO + H2O Більшість основ нерозчинні у воді. Добре розчинними є тільки луги. Серед лугів практично найбільш вживаними є NaOH, KOH, Ca(OH)2 і Ba(OH)2. У лужному середовищі фіолетовий колір лакмусу змінюється на синій, метилоранжу — на ясно-жовтий, а фенолфталеїн стає фіолетовим. Лужні властивості розчинів основ обумовлюються наявністю в розчині гідроксильних іонів. Добування: 1.сполученням основних оксидів з водою. Na2O + H2O = 2NaOH 2.Взаємодією їдких лугів, з розчинами солей: CuSO4 + 2KOH = Cu(OH)2 ↓ + K2SO4 3.Взаємодією найактивніших металів (K, Na, Ca, Ba) з водою: 2Na + 2H2O = 2NaOH + H2 ↑ 2.H2S. Це безбарвний, дуже отруйний, горючий газ з характерним неприємним запахом тухлих яєць, Цей газ утворюється в результаті вулканічної активності, входить до складу природного газу, і деяких вод. Людське тіло виробляє невелика кількість H2S в якості сигнальної молекули. Сірководень трохи важчий за повітря, суміш H2S і повітря — вибухонебезпечна. горить синім полум'ям, з утвореннмSO2 і води. відновник.При високій температурі або в присутності каталізатора, сірководень розкладається на елементарну сірку та воду. Добування: Б9 КИСЛОТИ. Кислоти – це сполуки які складаються з кислотного залишку і атомів гідрогену. Поділяються: на оксигено- і безскесигеновмісні; одно-, дво-, три-, чотири-, п’яти-, шестиосновні. Взаємодіють з основами, металами, солями, основними оксидами. Добування: 1.взаємодія кислотного оксиду з водою, 2. Дією іншої кислоти на відновлювану сіль, 3.безкисневі кислти добувають синтезом з водню і неметалу з наступним розчиненням водневої сполуки у воді. Деякі поширені кислоти можуть в різних джерелах мати різні назви: наприклад, водний розчин HCl може називатися соляної, хлороводородной, хлористоводневою кислотою. Номенклатура кислот. Назви кисневмісних кислот утворюють з назв кислотоутворюючого елемента та слова кислота. При цьому назва кислоти, в якій елемент виявляє вищий ступінь окислення, має закінчення -на, -ієва(ева), -ова. Із зниженням ступеня окислення кислотоутворюючого елемента закінчення кислот змінюються в такій послідовності: -нувата, -иста, -нуватиста. Якщо елемент утворює дві кислоти, то назва з нижчим ступенем окислення елемента має закінчення -иста. SO2 безбарвний газ, з різким задушливим запахом. Сірка в ньому позитивно чотиривалентна. Тому атом сірки в молекулі SO2 може або віддавати ще два електрони, або приєднувати чотири або шість електронів. Отже, в залежності від умов діоксид сірки може бути відновником або окисником. Більш різко в нього виріажені відновні властивості. При взаємодії з окисниками SO2 виявляє відновні властивості. Наприклад: S4+О2 + I02 + H2O = H2S6+О4 + 2HІ. При взаємодії з дуже сильними відновниками він виявляє окиснювальні властивості: S4+O2 + 2H2S2- = 3S0 ↑ + 2H2O. - хімічна сполука, нестійка кислота, що утворюється при розчинені діоксиду сірки у воді. Існує лише у водному розчині, і тому не виділена в чистому вигляді. Б10 1.СОЛІ - о рганічні речовини, утворені металом і кислотним залишком. Бувають: звичайна(Ме+кис.залишок), кисла(зявляється Н), основна(зявляється ОН MgOHCl), подвійна(два метали і кисл.залишок KAl(SO4)2), комплексні (комплексні іони K4[Fe(CN)6]) взаємодіють з кислотами, основами, металами, солями. Назви середніх солей утворюються з двох слів: назви металу у називному відмінку та назви аніона кислоти, наприклад: СаSО4 – кальцій сульфат; КСl – калій хлор. H2SO4 - Безбарвна масляниста,дуже в'язка і гігроскопічна рідина. Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються один або два аніони гідрогену на катіони металів. Сірчана кислота є однією з найважливіших технічних речовин у світі і лідирує за кількістю виробництва. Вона в основному використовується для виробництва добрив і інших неорганічних кислот. В основному використовуються водні розчини цієї кислоти. Добування: 1.випалювання в «киплячому шарі»(циклон, електрофільтр, сушильна башта, теплообмінник) 2.Контактний апарт, 3.Вбирна башта. Лакмус і метил оранж – рожевий. Реагує з солями, металами, оксидами. Концентрована звуглює орг..речовини. застосування: як проносне. При дії розведеної сульфатної кислоти на метали, які у електрохімічному ряді активності металів розташовані ліворуч водню, виділяється водень. Концентрована сірчана кислота має сильний окислювальний ефект і здатна реагувати, при нагріванні, навіть з благородними металами, такими як мідь, ртуть і срібло, хоча при цьому вона не взаємодіє з залізом. Тому для перевезення концентрованої сульфатної кислоти використовуються залізні цистерни. В11 1.періодичний закон - властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від значень зарядів ядер атомів. 2. сульфати. Сульфа́ти — солі сірчаної кислоти — H2SO4.Сульфатна кислота утворює два ряди солей: нормальні солі, які називають сульфатами, і кислі, які називають гідрогенсульфатами. Сульфати у більшості добре розчинні. До малорозчинних належать сульфат кальцію CaSO4 і сульфат свинцю PbSO4. Нерозчинним у воді є сульфат барію BaSO4. Багато сульфатів широко застосовується у практиці, наприклад BaSO4, CaSO4 і CuSO4. Сульфати міді та заліза іноді називають купоросами. Б12 1. Теорія Резерфорда: кожний електрон обертається навколо атомного ядра, причому сила притягання ядра зрівноважується відцентрованою силою, яка виникає при обертанні електрона. Теорія Бора: проминиста енергія виділяється і вбирається певними порціями – квантами. 2.азот і фосфор. У вільному стані фосфор буває в кількох алотропічних модифікаціях. Найбільше значення мають так звані білий і червоний фосфор. Білий фосфор являє собою безбарвну воскоподібну речовину з жовтуватим відтінком, через що його називають також жовтим фосфором. Білий фосфор — легкозаймиста речовина. Червоний фосфор являє собою порошкоподібну речовину червоно-бурого кольору, не отруйний і в сірковуглеці не розчиняється. При охолодженні пари фосфору переходять у білий фосфор. Чорний фосфор – речовина, схожа на графіт, має шарувату будову. Він масний на дотик, з металічним блиском, виявляє властивості напівпровідників. Реагую з киснем, неметалами, з багатьма металами, утворюючи фосфіди: 2P + 3Ca = Ca3P2. при дії на фосфід кальцію розведеної хлоридної кислоти утворюється фосфін PH3. Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO. В13 1. головне квантове число – це число, що позначає номер енергетичного рівня. Воно характеризує запас енергії електронів, які займають даний енергетичний рівень. Орбітальне квантове число – характеризує форму орбіта лі, електричної хмари і має значення (0,1,2,3). Магнітне квантове число – характеризує просторове розміщення орбіта лей, число його значень залежить від орбітального квантового числа і вказує на число орбіта лей. Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO. 2.Азот — газ без кольору, запаху, смаку. Азот не підтримує ні дихання, ні горіння. У воді розчиняється мало. Щоб розкласти молекулу азоту на атоми, треба витратити значну кількість енергії. Тому азот при звичайних умовах хімічно досить пасивний. При високих температурах, коли молекули N2 розкладаються і азот переходить в атомарний стан, він легко вступає в реакції з металами, утворюючи нітриди: 6Li + N2 = 2Li3N (нітрид літію) При високій температурі, високому тиску і наявності каталізатора нітроген сполучається з гідрогеном з утворенням амоніаку. при грозових розрядах: N2 + O2 = 2NO. В14 1Електро́нна конфігура́ція — формула розташування електронів на різних електронних оболонках атома хімічного елемента. Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента (порядковим номером). Аби зрозуміти, як побудована електронна оболонка атома, потрібно з'ясувати, як розподіляється електронна густина біля ядра, тобто визначити ділянку простору, де можуть перебувати електрони даного атома.Число електронів на оболонці дорівнює числу протонів у ядрі атома і визначається протонним числом елемента. Електрони в атомі розмішуються на різній відстані від ядра. Це пояснюється тим, що електрони мають різний запас енергії. Одні з них сильніше притягуються до ядра і розмішуються ближче до нього, вони міцніше зв'язані з ядром і їх важче вирвати з електронної оболонки. Інші — слабкіше притягуються і перебувають далі від ядра. Принцип Паулі:в атомі не може бути електронів з однаковим значенням усіх 4 квантових чисел. Правило Гунда:електрони розміщуються на однакових орбіталях таким чином,щоб сумарний спін був максимальним 2. Аміа́к, NH3 — неорганічна сполука, безбарвний газ із різким задушливим запахом, легший за повітря майже у два рази, добре розчинний у воді (при 0°С в 1 об'ємі води розчиняється 1200 об'ємів NH3, а при 20°С - 700 об'ємів). Використовують переважно для виробництва азотних добрив, вибухових речовин і азотної кислоти. Рідкий аміак використовується в холодильних установках. Водний розчин аміаку (нашатирний спирт) застосовується в медицині. Його зберігають і транспортують у рідкому стані в стальних балонах під тиском 6—7 атм. При нагріванні розчину аміак легко випаровується. Хімічні властивості. Молекули аміаку утворюються за допомогою ковалентних зв'язків.Однак зв'язки N—Н в молекулі аміаку полярні, оскільки електронна пара зміщена до атома азоту. Тому атом азоту має негативний заряд, а атом водню — позитивний. У хімічному відношенні аміак є відновником, а сам звичайно окиснюється до вільного азоту. Так, в атмосфері кисню аміак горить за реакцією:4NH3 + 3O2 = 2N2 + H2O. Амоніак також легко відновлює монооксид міді до металічної міді при високій температурі за реакцією: 3CuO + 2NH3 = 3Cu + N2 + 3H2O. В розчині аміаку в рівновазі одночасно існують молекули аміаку, води і гідроксиду амонію та іони амонію і гідроксилу. Гідроксид амонію є дуже нестійкою речовиною і може існувати лише в розчині. При нагріванні розчину рівновага зміщується вліво, і розчин розкладається на вихідні речовини. Цей розклад частково відбувається і при звичайній температурі, тому розчини аміаку завжди мають специфічний запах. При тривалому кип'ятінні розчину можна повністю видалити аміак. Розчин гідроксиду амонію забарвлює лакмус у синій колір. З кислотами розчин гідроксиду амонію утворює солі, наприклад:NH4OH + HCl = NH4Cl + H2O. Добування аміаку. В лабораторних умовах відбувається в дві стадії: 2NH4Cl + Ca(OH)2 = 2NH4OH + CaCl2. Потім:NH4OH = NH3↑ + H2O.. промисловий спосіб: N2+3H2=2NH3 Б15 1.Хімічний зв'язок — взаємодія двох або кількох атомів, у результаті якої утворюється хімічно стійка система(молекула або кристал) з чітко визначеним складом. Ковалентний зв'язок - зв'язок утв. за рахунок спільних електронних пар
Іонний хімічний зв’язок — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситься електростатичною взаємодією. (між металом і неметалом) Утворюється між атомами або групами атомів зі значною різницею в електронегативностях. Металічний хімічний зв’язок – такий вид хім. зв’язку який виникає внаслідок протягування між йонами і узагальненими електронами. Водневий хімічний зв’язок – виникає між атомами гідрогену і дуже електронегативним елементом. 2.Нітроген утворює оксиди, у яких він виявляє ступінь окиснення від +1 до +5: Б16 Хімічні реакції Перетворення речовин, що супроводжуються зміною їхнього складу і (або) будови, називаються хімічними реакціями.
2.Азотна кислота, нітратна кислота (HNO3) — сильна одноосновна кислота. Висококорозійна кислота, реагує з більшістю металів, сильний окисник. Має тенденцію набувати жовтого відтінку через накопичення оксидів азоту, при довгому зберіганні. Нітратна кислота — дуже сильний окисник. Окислює сірку (до H2SO4), фосфор (до фосфорної кислоти), руйнує органічні речовини. Ступінь відновлення HNO3 залежить від її концентрації і активності відновника. Концентрована HNO3 відновлюється до NO2, а розведена — звичайно до NO. Нітратна кислота взаємодіє майже зі всіма металами, за винятком золота, платиниі деяких інших, утворюючи солі — нітрати. Так, при дії концентрованої нітратної кислоти на мідь утворюється нітрат міді, діоксид азоту і вода: Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O При дії ж розведеної нітратної кислоти на мідь утворюється нітрат міді, монооксид азоту (а не діоксид; як при дії концентрованої HNO3) і вода: 3CuO + 2HNO3 + 6HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Нітрати — безбарвні кристалічні речовини, солі і ефіри азотної кислоти HNO3. Вони утворюються при взаємодії нітратної кислоти з відповідними металами, або їх оксидами та гідроксидами. У воді нітрати добре розчиняються. При сильному нагріванні нітрати розкладаються, не плавлячись. Виняток становлять лише нітрат натрію і нітрат калію, які спочатку плавляться, а потім уже розкладаються. При цьому продукти розкладу нітратів залежать від активності металу, що входить до складу солі. Б17 Швидкість хімічної реакції Швидкість хімічної реакції визначається кількістю речовини, що прореагувала за одиницю часу в одиниці об’єму. 1) Природа реагуючих речовин. |
||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 817; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.66.104 (0.011 с.) |

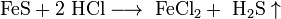 ..
..  Хімічні властивості: при достатньому доступі кисню сірководень горить на повітрі з утворенням двоокису сірки і водяної пари:
Хімічні властивості: при достатньому доступі кисню сірководень горить на повітрі з утворенням двоокису сірки і водяної пари:  При недостатньому доступі кисню, згоряє з утворенням води і виділенням вільної сірки:
При недостатньому доступі кисню, згоряє з утворенням води і виділенням вільної сірки:  У водному розчині сірководень легко окиснюється галогенами:
У водному розчині сірководень легко окиснюється галогенами:  Він діє як розслаблювач гладких м'язів і, як судинорозширювач, також бере активну участь в роботі мозку, де він збільшує реакцію рецепторів і полегшує довгострокове потенціювання, яке бере участь у формуванні пам'яті. Сірководень в наш час визнаний як потенційний захисник від серцево-судинних захворювань. Сірководень також бере участь в процесі 1 типу діабету. Бета-клітин підшлункової залози при цукровому діабеті.
Він діє як розслаблювач гладких м'язів і, як судинорозширювач, також бере активну участь в роботі мозку, де він збільшує реакцію рецепторів і полегшує довгострокове потенціювання, яке бере участь у формуванні пам'яті. Сірководень в наш час визнаний як потенційний захисник від серцево-судинних захворювань. Сірководень також бере участь в процесі 1 типу діабету. Бета-клітин підшлункової залози при цукровому діабеті.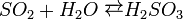

 ; NO;
; NO;  ;
; 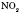 ;
; 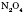 ;
;  .
. — розкладання
— розкладання  — обміну
— обміну  — заміщення
— заміщення 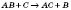
 де
де  — середня швидкість хімічної реакції,
— середня швидкість хімічної реакції,  — зміна концентрації реагенту,
— зміна концентрації реагенту,  — час.
— час. :
: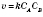 ,де k — коефіцієнт;
,де k — коефіцієнт;  і
і  — концентрації реагуючих речовин (моль/л).
— концентрації реагуючих речовин (моль/л).


