
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Періодичність властивостей хімічних елементівСодержание книги
Поиск на нашем сайте
Усі властивості елементів, що визначаються електронною будовою атома, закономірно змінюються по періодах і групах періодичної системи. Хімічна природа елемента обумовлена здатністю його атома втрачати або приєднувати електрони. Ця здатність може бути кількісно оцінена енергією іонізації атома та його спорідненістю до електрона. Енергією іонізації (I)називається кількість енергії, необхідної для відриву електрона від незбудженого атома: Е° + I = Е+ + ē, кДж/моль або еВ/атом. Значення енергії іонізації в електрон-вольтах на атом чисельно дорівнює потенціалам іонізації у вольтах. Для багатоелектронних атомів енергії іонізації I 1, I 2, I 3, … відповідають відриву першого, другого та інших електронів. При цьому завжди I 1< I 2 < I 3, оскільки збільшення числа відірваних електронів зумовлює зростання позитивного заряду іона, що утворюється. Енергія іонізації атома сильно залежить від його електронної конфігурації. Так завершені електронні шари проявляють підвищену стійкість. Найменші значення енергії іонізації I 1 мають s-елементи І групи (Li, Na, К). Значення ж енергії іонізації I 2 у них різко зростає, що відповідає видаленню електрона із завершеного шару (ns 2 np 6 і 2 s 2 у Li). Аналогічне для s -елементів ІІ групи (Be, Mg, Ca) видалення електрона із завершеного шару (ns 2 np 6 і 2 s 2 у Be) обумовлює різке підвищення енергії іонізації I 3. Найменшу енергію іонізації (3-5 еВ) мають s -елементи І групи, найбільшу – s - і р -елементи VIII групи. Зростання енергії іонізації під час переходу від s -елементів першої групи до р -елементів восьмої групи обумовлюється зростанням заряду ядра. Із переходом від s -елементів I групи до р -елементів VIII групи енергія іонізації змінюється немонотонно, із проявом внутрішньої періодичності. Порівняно велике значення енергії іонізації мають елементи II групи (Be, Mg, Ca) і V групи (N, P, As). У той же час порівняно менші значення енергії іонізації мають елементи III (B, Al, Ga) і VI (О, S, Se) груп. Спорідненістю до електрона(F) називається енергетичний ефект процесу приєднання електрона до нейтрального атома Е з перетворенням його на негативний іон Е-: Е + ē = Е- ± F, кДж/моль або еВ/атом. Спорідненістю до електроначисельно дорівнює енергії іонізації негативно зарядженого іона Е-, але протилежна за знаком.
Дійсні значення спорідненості до електрона знайдені лише для невеликої кількості елементів. Зрозуміло, що спорідненість до електрона залежить від електронної конфігурації атома, і в характері її зміни зі збільшенням порядкового номера елемента спостерігається виражена періодичність. Найбільшу спорідненість до електрона мають р-елементи VII групи. Найменші й навіть негативні значення мають атоми з конфігурацією s 2 (Be, Mg, Zn) і s 2 p 6 (Ne, Ar, Kr) або з напівзаповненою р -оболонкою (N,P,As). Це є додатковим доказом стійкості електронних конфігурацій. Виділенням енергії супроводжується приєднання одного електрона до атомів Оксигену, Сульфуру, Карбону та деяких інших. Таким чином, для вказаних елементів сили притягання до ядра додаткового електрона виявляються більшими, ніж сили відштовхування між додатковим електроном і електронною оболонкою атома. Подальше приєднання електронів до атома, тобто двох, трьох і більше згідно з квантово-механічними розрахунками неможливе. Поняття електронегативності (c) умовне. Воно дозволяє оцінити здатність атома певного елемента відтягувати на себе електронну густину порівняно з атомами інших елементів у сполуках. Очевидно, що ця здатність залежить від енергії іонізації атома та його спорідненості до електрона. Згідно з одним із визначень (за Маллікеном) електронегативність атома може бути виражена як півсума його енергії іонізації та спорідненості до електрона: c=1/2(I + F). Існує близько 20 шкал електронегативності. Значення електронегативності різних шкал відмінні, але відносне розташування елементів у ряді електронегативності однакове. У шкалі електронегативності Полінга електронегативність Флуору дорівнює 4,0. У періодах спостерігається загальна тенденція до зростання електронегативності елементів, а в підгрупах – до її зменшення. Найменшими значеннями електронегативності характеризуються s-елементи І групи, а найбільшими – р -елементи VII групи. Строго кажучи, елементу не можна приписати постійну електронегативність. Вона залежить від багатьох чинників, зокрема від валентного стану еле-мента, типу сполуки, до якої він входить та ін. Проте це поняття потрібне для якісного пояснення властивостей хімічного зв'язку в сполуках.
Атомні радіуси. Радіуси атомів та іонів є дуже важливою характеристикою. Із урахуванням цього геометричного параметра була пояснена велика кількість експериментальних фактів і властивостей хімічних елементів і їх сполук. Атомні радіуси елементів змінюються періодично залежно від їх порядкового номера. Зменшуючись від лужного металу до галогену, атомний радіус наступного лужного металу знову збільшується порівняно з радіусом атома попереднього. Так, атом Натрію має радіус 0,186 нм, Магнію – 0,16 нм, Хлору – 0,099 нм, а радіус атома Калію знову збільшується - 0,231 нм. Таким чином, загальна закономірність у зміні радіусів полягає в тому, що в межах заповнення електронами підрівня (s -, p -, d - або f -) атомні радіуси, як правило, зменшуються. Пояснити це можна тим, що зі зростанням заряду сила притягання ядра більша, ніж взаємне відштовхування електронів. Звичайно атомні радіуси помітно збільшуються по групах періодичної системи зверху вниз. Це спостерігається, наприклад, у лужних і лужноземельних металів, галогенів та ін. У зв’язку з тим, що між 4 s -елементом Кальцієм і 4 р -елементом Галієм знаходиться десять 3 d -елементів, радіус атома Галію (0,122 нм) менший радіуса атома Алюмінію (0,143 нм). Радіус же атома d -елемента Скандію (0,16 нм) більший радіуса атома Алюмінію. Тому хімічні властивості Галію не відповідають ряду B – Al – Ga, а властивості Скандію навпаки, не зважаючи на те, що B, Al, Ga – р -елементи, а Скандій – d -елемент. Другий виняток із загальної закономірності збільшення атомних радіусів у групах спостерігається в елементів, наступних після лантаноїдів. Зменшення радіусів атомів лантаноїдів зі збільшенням атомної маси називається лантаноїдним стисненням. Причина його та сама – зі збільшенням заряду ядра сильнішає притягання електронів. Число ж електронних шарів у межах одного періоду не збільшується. У результаті лантаноїдного стиснення атомний радіус Гафнію (0,157 нм) дорівнює радіусу Цирконію (0,157 нм), що як наслідок обумовлює дуже велику схожість у поведінці Цирконію і Гафнію, Ніобію і Танталу. Крім лантаноїдного існує й актиноїдне стиснення для 5 f -елементів. Із переходом по періоду зліва направо на одну клітинку радіуси атомів та іонів зменшуються приблизно на стільки, на скільки вони збільшуються із переходом зверху вниз по групі. Таким чином, радіуси сусідніх елементів, розташованих по діагоналі, наприклад Li і Mg, а також Be і Al, близькі. Це положення було висловлене ще Д.І.Менделєєвим. Воно лежить в основі діагональної закономірності. Відповідно до неї Літій за деякими властивостями більше нагадує Магній, ніж решта лужних металів. Так само як і Магній, Літій дає малорозчинні фосфат і карбонат. Обидва метали порівняно легко взаємодіють із молекулярним азотом, утворюючи нітриди. Таким чином, знаючи положення елемента в періодичній системі, можна передбачати властивості його сполук, застосовуючи такі відомості: 1. Склад вищих солетворних оксидів елементів визначається номером групи (табл. 5).
Таблиця 5. Формули характерних сполук хімічних елементів
2. Гідрогеновмісні леткі сполуки певного складу утворюються лише неметалами, тобто елементами тільки головних підгруп IV – VII груп (табл. 5). Слід розрізняти загальне поняття “гідриди елементів” і конкретне “леткі гідрогеновмісні сполуки”. Гідриди – сполуки з Гідрогеном різного складу та природи утворюють майже всі елементи, а леткі гідрогеновмісні - тільки неметали.
3. У періодах хімічні властивості змінюються від металічних (елементи початку періодів) через проміжні між металічними та неметалічними до неметалічних (елементи кінця періодів). У великих періодах це відбувається повільніше, ніж у малих у зв’язку із сукупністю перехідних елементів. 4. У головних підгрупах зі зростанням атомних мас збільшуються металічні та зменшуються неметалічні властивості, зростають густини простих речовин, знижуються температури плавлення простих речовин металів і підвищуються температури плавлення простих речовин неметалів. Ці явища пояснюються на основі електронної будови атомів. 5. Властивості кожного елемента виражаються як середні між властивостями елементів, що оточують його в періодичній системі з чотирьох боків. ПІДСУМКИ Необхідно зрозуміти 1. Властивості хімічних елементів, а також утворених ними сполук залежать від електронної будови їх атомів. 2. До основних закономірностей періодичної системи належить ослаблення металічних властивостей у періодах зліва направо і їх посилення в групах зверху вниз. 3. Кожен елемент періодичної системи за своїми властивостями схожий на сусідні з ним елементи. Треба вміти 1.Розрізняти в періодичній системі періоди, групи, головні та побічні підгрупи. 2.Застосовувати інформацію, закладену в періодичній системі, для характеристики елементів, простих речовин і сполук. 3.Аналізувати зміни властивостей простих речовин залежно від розміщення елементів у періодичній системі. Слід запам’ятати 1.Формулювання періодичного закону Д.І.Менделєєва. 2.Визначення структурних елементів періодичної системи хімічних елементів. 2.Періодичну зміну основних атомних характеристик елементів. Хімічний зв’язок Уявлення про атоми як найдрібніші частинки речовини були сформовані грецькими філософами, проте наукове обґрунтування атомно-молекулярне вчення отримало лише тоді, коли у вчених-фізиків з’явилась можливість проводити точні експерименти. Кількісне дослідження хімічних перетворень і самих речовин допомогло усвідомити природу хімічних сполук, провести чітку межу між ними та механічними сумішами.
Першу спробу відповісти на питання, чому і як атоми сполучаються між собою, зробив Берцеліус, який вважав, що в основі хімічних явищ лежать електричні процеси, тобто з’єднання атомів двох різних елементів відбувається у зв’язку з їх різними зарядами. За цією позицією всі елементи розділялись на дві великі групи металічні (позитивно заряджені) та неметалічні (негативно заряджені), а хімічні реакції зводились до взаємодії атомів металів з атомами неметалів. У той же час для пояснення “аномального” характеру взаємодії водню з хлором, коли один об’єм водню, з’єднуючись із одним об’ємом хлору, дає не один, а два об’єми HCl, Авогадро ввів поняття про молекулярну будову простих речовин, яке не суперечило експерименту. Учений запропонував замість H+Сl=HCl писати H2+Cl2=2HCl. Революційні погляди Авогадро не були сприйняті сучасниками, оскільки не узгоджувалися із теорією Берцеліуса про природу хімічного зв’язку. Примирення антагоністичних поглядів Берцеліуса й Авогадро стало можливим після створення чітких уявлень про будову атомів. Аналіз характеру змін хімічної активності різних елементів залежно від заповненості електронами їх зовнішньої (валентної) оболонки дозволив Льюїсу та Косселю висловити припущення, що найбільш стійкою з можливих комбінацій є октетна електронна конфігурація. Тому ті атоми, які її мають зовні (Неон, Аргон та ін.), – інертні, інші – намагаються її досягти. На цих уявленнях була створена електронна теорія хімічного зв’язку, згідно з якою атоми в процесі взаємодії між собою набувають октетної заповненості електронами зовнішньої оболонки. Це досягається або втратою надлишку, або приєднанням необхідної кількості електронів, коли атоми стають іонами з октетною периферією, або шляхом так званого усуспільнення зовнішніх електронів, коли створений октет належить обом атомам, що провзаємодіяли. Автори електронної теорії хімічного зв'язку припускали також, що атоми взаємодіють між собою за рахунок спарювання наявних неспарених валентних електронів. Як бачимо, теорія Берцеліуса є окремим випадком теорії Льюїса і Косселя. Причому в теорії Берцеліуса результат певного виду хімічної взаємодії, яка за-вершується створенням заряджених атомів (іонів), вважався самою хімічною взаємодією. Декілька десятків років електронна теорія хімічного зв'язку вдосконалювалась, доповнювалась, але з часом стала очевидною її обмеженість. Зокрема, вона не могла пояснити: - чому енергія спін-спінової взаємодії електронів суттєво (на декілька порядків) менша, ніж енергія хімічного зв'язку, який утворюється під час спарювання атомних електронів; - чому в молекулі кисню залишаються неспарені електрони; - чому існують іони Н2+ тощо. Величезна кількість питань обумовила припущення, що закони, за якими з позитивно зарядженого ядра та негативно заряджених електронів побудовані атоми, незмінні і для молекул, утворених із багатьох атомних ядер і супутніх їм електронів. Так з'явилася теорія молекулярних орбіталей (МО). Згідно з розвинутим у ній сучасним уявленням хімічний зв'язок ототожнюється з так званою зв'язувальною молекулярною орбіталлю. Вона відрізняється від інших МО тим, що її енергія значно менша за суму енергій вихідних атомних орбіталей, на яких були розміщені електрони. Енергетична вигідність переходу електронів з атомних орбіталей на молекулярні і є тією рушійною силою, яка обумовлює взаємодію атомів і об'єднання їх у молекули.
3а типом МО почали розрізняти й типи хімічного зв'язку: s, p, d. Іонний зв’язок У багатоелектронних атомах зовнішні (валентні) електрони з різною силою притягуються ядром. Ця сила тим менша, чим більший радіус атома і чим більше електронів знаходиться між ядром і валентними електронами. Кількісно взаємодію валентних електронів із ядром оцінюють електронегативністю c. Якщо різниця електронегативностей тих атомів, що взаємодіють, перевищує 1,9 (за літієвою шкалою), то має місце іонний зв'язок. Наприклад, у разі взаємодії натрію (cNа=0,9) з хлором (cCl = 3,0) різниця електронегативностей становить 2,1 і є більша за 1,9, тому в даному випадку утворюється іонна сполука – натрій хлорид. В іонних сполуках атоми локалізують на собі значну кількість електричного заряду і розглядаються як самостійно заряджені частки - іони. Слід зауважити, що в речовині електричний заряд, який локалізується на атомах, завжди менший 1, навіть у випадку утворення сполуки з максимальною різницею електронегативностей складових елементів. Прикладом такої сполуки є цезій флуорид (СsF), де DcCsF=cCs-cF=3,3. У цій солі заряд іонів Цезію становить (+0,89), а іонів Флуору відповідно (–0,89). Не мають заряду, більшого за 1, і одноатомні багатозарядні іони: О2-, S2-, N3-, С4- тощо. Це пов’язано з тим, що приєднання до атомів двох і більше електронів з енергетичних міркувань (доведено квантово-хімічними розрахунками) практично неможливе. Так, у кальцій оксиді (СаО) заряд іонів Ca2+ дорівнює (+0,8), іонів O2- - (–0,80). У той же час існування багатоатомних іонів типу СО32-, РО43-, заряд яких перевищує 1, можливе, оскільки в них надлишок електронної густини розподіляється між усіма атомами, що входять до складу групи. Отже, іонний зв'язок - це електростатична взаємодія катіонів і аніонів. Характерні ознаки іонного зв'язку: ненапрямленість і ненасиченість. Ненапрямленість іонного зв'язку обумовлена тим, що електричне поле зарядженої частинки поширюється в просторі в усіх напрямках. Відсутність фізичних обмежень для взаємодії зарядженої частинки з будь-якою кількістю інших заряджених частинок обумовлює ненасиченість іонного зв'язку. Як наслідок - кожна частинка певного заряду оточує себе максимально можливою кількістю частинок, які мають заряд протилежного знака. Так, у кристалах натрій хлориду (NаСl) кожен катіон Na+ безпосередньо контактує аж із шістьма аніонами Сl-. З такою ж кількістю катіонів Nа+ контактує кожен аніон Сl-. Здатність притягувати до себе певну кількість протиіонів оцінюють координаційним числом (к.ч.). У випадку NаСl координаційне число в іонів Сl- і Nа+ однакове і дорівнює 6. Зрозуміло, що величина к.ч. залежить від співвідношення радіусів катіонів та аніонів: R(Каt)/R(Аn). Якщо R(Каt)/R(Аn) знаходиться в інтервалі 1,37 ¸ 0,73, то к.ч. = 8, що відповідає кубічній структурі кристалічної решітки. Якщо R(Каt)/R(Аn) = 0,73¸0,41, реалізується октаедрична структура з к.ч. = 6, а якщо R(Каt)/R(Аn) < 0,41 - встановлюється тетраедричне оточення іонів з к.ч. = 4. Особливість упорядкованого розташування в кристалічній решітці катіонів і аніонів обумовлює наявність у речовин з іонним типом хімічного зв'язку таких специфічних властивостей, як твердість і крихкість. Значна твердість кристалічних речовин пов'язана з тим, що кожен іон, взаємодіючи з великою кількістю протиіонів, міцно утримується у своєму вузлі, і для того щоб змістити один шар іонів відносно інших, потрібно докласти великих зусиль. Але якщо це вдається, то, як видно з рис. 11, кожен іон попадає на однойменні частинки, внаслідок чого іонні шари різко відштовхуються і кристал розділяється. У результаті багаторазової інтенсивної механічної дії кристал розпадається на велику кількість дрібних частинок, тобто розкришується.
Å Θ Å Θ Å Å Θ Å Θ Å
Å Θ Å Θ Å Відштовхування
Рис. 11. Механізм кришіння кристалічної речовини Ковалентний зв’язок Якщо ядра атомів діють на зовнішні електрони з близькою за величиною силою, створюється рівноважна система, у якій має місце збалансоване притягання протилежно заряджених часток і відштовхування однаково заряджених. У цьому випадку реалізовується так званий ковалентний зв’язок.
У подальшому уявлення В.Гайтлера і Ф.Лондона щодо механізму утворення ковалентного зв’язку в молекулі водню були застосовані й до більш складних молекул. Виходячи з такої схеми ковалентний зв’язок спочатку зображали у вигляді двох крапок між символами атомів, які хімічно взаємодіють між собою:
Ці пари крапок відповідали сумісним парам електронів. Потім їх замінили рисками:
що дало змогу зображати просторову будову молекул. Залежно від того, які орбіталі (s, p, d, f) і як взаємодіють між собою, можуть утворюватись різні типи ковалентного зв’язку: s, p чи d. У випадку утворення s-зв’язку електронні хмари мають лише одну зону перекриття:
s s s(s,s)
p s s(p,s)
p p s(p,p)
d s s(d,s) У процесі утворення p-зв’язку електронні хмари мають дві зони перекриття. Такий варіант взаємодії зі зрозумілих геометричних міркувань можливий для p, d та f електронів:
p p p(p,p)
p d p(p,d) Більш складні за формою d і f електронні хмари можуть мати 4 зони перекриття. У цьому випадку утворюється d-зв’язок, зумовлений перекриттям усіх пелюстків орбіталей, розміщених у паралельних площинах. Якщо ковалентний зв’язок утворюють однакові атоми, то сумісна електронна пара симетрично й рівномірно розташовується між їх ядрами (рис. 12, а). Такий зв’язок є неполярний. Коли взаємодіють атоми різних хімічних елементів, то задіяні в утворенні зв’язку валентні електрони з різною силою притягуються ядрами, внаслідок чого відбувається зміщення електронної пари в бік більш активного атома (рис. 12, б). Такий зв’язок називається полярним.
а б Рис. 12. Розподіл заряду сумісної електронної пари в молекулах: а – Н2; б – HСl
Кількісно ступінь полярності ковалентного зв’язку оцінюють, з одного боку, за величиною набутого атомами надлишку електронного заряду, а з іншого – його дефіциту. Для цього застосовують співвідношення
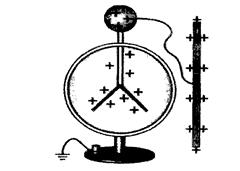
яке називають ефективним зарядом. У випадку молекули HCl dН = +0,17, dCl = -0,17. Під час переходу від HCl до молекули H2S полярність одиничного ковалентного зв’язку H-S зменшується, а ефективний заряд атома Сульфуру порівняно з атомом Хлору збільшується: dН = +0,1, dS = -0,2. Полярність ковалентного зв’язку впливає, а інколи й дуже суттєво, на геометрію молекули, якщо в ній більше ніж два атоми. Ті атоми, які набувають однакового за знаком заряду, відштовхуються один від одного, як пелюстки в електрометрі (рис. 13). Чим більший заряд локалізується на атомах, тим більшими стають сили відштовхування і валентний кут a.
Рис. 13. Ефект електростатичної взаємодії: а – в електрометрі; б – у молекулі води
Так, в ряді молекул H2Te, H2Se, H2S, H2O величина a збільшується від 90° до 104,5° пропорційно збільшенню ефективного заряду на атомах Гідрогену (табл. 6).
Таблиця 6. Значення валентних кутів
У наведеній групі молекул атоми центрального елемента (Te, Se, S, O) для взаємодії з атомами Гідрогену використовують два валентні р-електрони, а вони, як відомо, розташовані в просторі під кутом 90°. Таким чином, якби атоми Гідрогену не відштовхувались один від одного, то валентний кут у молекулах типу H2E становив би 90°. Відносно цього кута можна розрахувати збільшення a і зіставити Da з величиною dН. Слід звернути увагу на те, що відштовхування атомів у складних молекулах не лише збільшує валентний кут, а і впливає на енергетику й геометрію зв’язувальних молекулярних орбіталей, тобто s-зв’язків. Інколи деформація буває настільки значною, що форма кінцевої молекулярної орбіталі повністю відрізняється від вихідної. У такому випадку говорять про гібридизацію s-зв’язків. Наочно гібридизаційний ефект можна продемонструвати на класичному прикладі молекули метану. У ній атом Карбону для взаємодії з атомами Гідрогену в збудженому стані використовує один s і три р валентні електрони. У разі відсутності відштовхування полярних фрагментів у молекулі СН4 утворились би три s(s, p)-зв’язки і один s(s, s)-зв’язок, які мають принципово різну форму (див. схеми різних типів зв’язків). Замість цього утворюються чотири усереднені рівноцінні зв’язки нової форми. За типом і кількістю валентних атомних електронів, задіяних в утворенні такого виду зв’язків, характеризують тип гібридизації. Так, у молекулі СН4 має місце sp 3-гібридизація, у молекулі BF3 - sp 2-гібридизація, у молекулі BeF2 – sp -гібридизація. Установити факт гібридизації можна за величиною валентного кута (табл. 7)
Таблиця 7. Типи молекулярних структур
У тих випадках, коли валентний кут наближається до вказаного в табл. 7, теж говорять про наявність гібридизації зв’язків. Так, у молекулі аміаку a=107°29¢ і це дає змогу характеризувати її як тетраедричну структуру, у якій четвертим фрагментом є пара s -електронів атома Нітрогену. У молекулі РН3 a=94°, що вказує на деяку деформацію s-зв’язків, однак, не настільки сильну, щоб говорити про їх гібридизацію. У зв’язку з цим молекула фосфіну має пірамідальну структуру. ПІДСУМКИ Необхідно зрозуміти 1. Іонний зв’язок – це електростатична взаємодія іонів. Він є ненасиченим і ненаправленим. 2. Іонний зв’язок утворюється між атомами, різниця електронегативностей яких перевищує 1,9. 3. Однакові атоми утворюють неполярний ковалентний зв’язок, різні атоми - полярний зв’язок. 4. Відштовхування однаково заряджених атомів у молекулах обумовлює збільшення валентного кута, сильне відштовхування завершується гібридизацією s-зв’язків. Треба вміти 1.Розрізняти види хімічного зв’язку: іонний та ковалентний. 2.Визначати типи гібридизації. 3.Визначати геометрію молекул. Слід запам’ятати 1.Полярність ковалентного зв’язку оцінюють за величиною ефективних зарядів атомів 2. Тип гібридизації визначають за типом і кількістю валентних електронів, задіяних в утворенні s-зв’язків.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 268; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.14.208 (0.011 с.) |

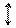
 Уперше на прикладі водню В. Гайтлер і Ф. Лондон розглянули такий варіант взаємодії атомів. На рис. 12 показана запропонована ними схема сукупних взаємодій протонів і електронів у молекулі водню.
Уперше на прикладі водню В. Гайтлер і Ф. Лондон розглянули такий варіант взаємодії атомів. На рис. 12 показана запропонована ними схема сукупних взаємодій протонів і електронів у молекулі водню.












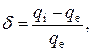

 О
О
 Н Н
dН= + dН= +
Н Н
dН= + dН= +




