
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тиск суміші газів, які хімічно не взаємодіють один із одним, дорівнює сумі їх парціальних тисків.Содержание книги
Поиск на нашем сайте Візьмемо 1 моль газу. Тоді за законом Авогадро за однакових фізичних умов об'єми 1 моля всіх газів повинні бути однакові, оскільки в них міститься однакове число молекул, що дорівнює сталій Авогадро N A, і величина Р 0 V 0 /T 0 буде мати стале значення R =8,31 Дж/моль×К (універсальна газова стала). Рівняння (1) набуває такого вигляду: PV = RT, а для кількості речовини n (моль) = m/M –
Цей вираз називається рівнянням Менделєєва-Клапейрона. Наслідки із закону Авогадро: 1)за нормальних тиску й температури 1 моль будь-якого газу займає об'єм 22,4 л; 2)густини двох газів за однакових тиску й температури прямо пропорційні їх молярним масам:
Відносна густина газу (D) дорівнює відношенню молярної маси газу до молярної маси газу, взятого за зразок. 5. Закон еквівалентів, або еквівалентних відношень, відкритий Ріхтером у 1792 р. Але перш ніж дати визначення закону слід ввести поняття еквівалента, фактора еквівалентності, молярної маси еквівалента.
На основі рівняння хімічної реакції 2H2 + O2 = 2H2O
m (H2): m (O2) = 4:32= 1:8. Це масове відношення для даної реакції стале. Отже, можна стверджувати, що в реакцію з 1/2 молекули водню (її маса дорівнює 1/2×2=1) вступають 1/4 молекули кисню (її маса становить 1/4×32=8). При цьому відношення кількості молекул водню до кількості молекул кисню також дорівнює 1/2:1/4 = 2:1. Згідно із сучасними уявленнями хімічні еквіваленти – це умовні частинки речовини, їх у z разів менше, ніж реальних частинок, що відповідають певній хімічній формулі. Реальні частинки: H2 O2 H2O Хімічні еквіваленти: 1/2H2 1/4O2 1/2H2O Число z називають еквівалентним числом, z ³ 1. Значення z встановлюють за хімічною реакцією, у якій бере участь дана речовина. Обернену величину еквівалентного числа 1/z називають фактором еквівалентності. Еквівалент –це реальна чи умовна частинка речовини, яка в певній кислотно-основній реакції еквівалентна (рівноцінна) одному катіону Гідрогену чи в певній окисно-відновній реакції - одному електрону. Число, що визначає, яка частка реальної частинки речовини еквівалентна одному катіону Гідрогену в певній кислотно-основній реакції чи одному електрону в певній окисно-відновній реакції, називають фактором еквівалентності - f екв. Фактор еквівалентності не має розмірності. Його розраховують на підставі стехіометричних коефіцієнтів певної хімічної реакції. Наприклад, а) Н2S + 2NaOH = Na2S + 2H2O. У реакції беруть участь 2 катіони Гідрогену кожної молекули гідроген сульфіду. Таким чином, двом катіонам Гідрогену еквівалентна одна частинка (молекула) гідроген сульфіду, а одному катіону Гідрогену еквівалентна 1/2 молекули H2S. Тобто f екв(H2S) = 1/2. б) H2S + NaOH = NaHS + H2O. У реакції беруть участь тільки по одному катіону Гідрогену кожної молекули H2S. Так, одна молекула гідроген сульфіду еквівалентна одному катіону Гідрогену. Тобто f екв (Н2S) = 1. в) 2H2S + 3O2 = 2H2O + 2SO2 – окисно-відновна реакція. Ступінь окиснення Сульфуру змінюється від (–2) до (+4). Молекула H2S віддає 6 електронів, тобто одна молекула Н2S еквівалентна 6 електронам, а одному електрону еквівалентна 1/6 молекули гідроген сульфіду, тобто f екв (H2S) = 1/6. Отже, 1)еквівалент однієї і тієї ж речовини може бути різним залежно від того, у якій реакції бере участь ця речовина, тобто для того щоб розрахувати еквівалент і фактор еквівалентності, необхідно вказати, про яку реакцію йде мова. 2)фактор еквівалентності може дорівнювати 1 і бути меншим за 1. Кількість еквівалентів вимірюється в молях, як і будь-яка кількість речовини. Молярна маса еквівалентів – це маса еквівалентів кількістю 1 моль, вона дорівнює добутку фактора еквівалентності на молярну масу речовини:
За аналогією з молярною масою можна записати
Для реакції а) Н2S + 2NaOH = Na2S + 2H2O М f(H2S) = 1/2×34 = 17 г/моль; б) H2S + NaOH = NaHS + H2O M f(H2S) = 1×34 = 34 г/моль; в) 2H2S + 3O2 = 2H2O + 2SO2 M f(H2S) = 1/6×34 = 5,68 г/моль. Молярні маси еквівалентів таких речовин, як водень і кисень, є сталими величинами: M f(Н2) = М (1/2H2) = М f(О2) = М (1/4О2) = Тепер можна сформулювати закон еквівалентних відношень: маси (об’єми) реагуючих речовин пропорційні молярним масам (об’ємам) їх хімічних еквівалентів:
де Vf – еквівалентний об’єм газоподібної речовини.
За нормальних умов еквівалентний об’єм дорівнює V f = f × 22,4 л/моль. V f(Н2) = 1/2×22,4 = 11,2 л/моль; V f(О2) = 1/4×22,4 = 5,6 л/моль Із закону еквівалентних відношень випливає, що в хімічні реакції вступають речовини в еквівалентному відношенні: nекв(А) = nекв(В). Для визначення молярних мас еквівалентів складних сполук необхідно враховувати хімічну реакцію, у якій бере участь дана речовина і клас, до якого належить ця речовина (див. табл. 1).
Таблиця 1. Визначення молярних мас еквівалентів сполук
ПІДСУМКИ Необхідно зрозуміти 1. На підставі закону збереження маси речовин можна проводити обчислення кількісних відношень реагентів та продуктів реакції. 2. Розрахунки кількостей речовин-реагентів та продуктів реакції можна значно спростити, якщо застосовувати закон еквівалентних відношень. 3. Закон об’ємних співвідношень дозволяє обчислити об’ємні відношення газоподібних речовин, що беруть участь у хімічній реакції чи утворюються під час її перебігу. Треба вміти 1.Визначати відносні молекулярні та молярні маси речовин; кількість частинок у певній кількості речовини, масі речовини, об’ємі газу; об’єм певної маси або кількості речовини газу за нормальних умов; відносну густину газу за іншим газом; масову частку елемента у сполуці за її формулою. 2.Встановлювати хімічну формулу речовини за масовими частками елементів, що входять до її складу. 3.Визначати молярні маси газоподібних речовин за молярним об’ємом, відносною густиною, рівнянням Менделєєва-Клапейрона. 4.Обчислювати за рівняннями хімічних реакцій масу, об’єм, кількість речовини за відомою масою, кількістю речовини одного з реагентів чи продуктів реакції. 5.Здійснювати перехід від нормальних до експериментальних умов на підставі газових законів. 6.Обчислювати молярні маси еквівалентів різних речовин. 7.Проводити розрахунки на основі закону еквівалентних відношень. Слід запам’ятати
M екв(Н2) = М (1/2H2) = М екв(О2) = М (1/4О2) = M f (AaBb) =
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 258; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |

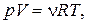 чи
чи 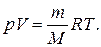
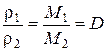 .
. Розв’язування ряду розрахункових задач із хімії значно спрощується, якщо застосовувати поняття хімічних еквівалентів. Воно відіграло революційну роль у хімії в минулому столітті, коли формувалися поняття про атоми, молекули, атомні маси й валентності.
Розв’язування ряду розрахункових задач із хімії значно спрощується, якщо застосовувати поняття хімічних еквівалентів. Воно відіграло революційну роль у хімії в минулому столітті, коли формувалися поняття про атоми, молекули, атомні маси й валентності.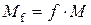 .
.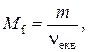 г/моль.
г/моль.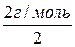 = 1 г/моль;
= 1 г/моль;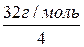 = 8 г/моль.
= 8 г/моль.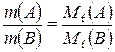 ;
;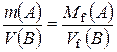 ,
, , л/моль.
, л/моль.
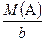
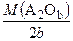 = M f(А) + М f(О) = M f(А) + 8
= M f(А) + М f(О) = M f(А) + 8
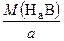 = M f(Н) + М f(Вa-) = 1 + М (B)/ a
= M f(Н) + М f(Вa-) = 1 + М (B)/ a
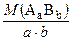 =
= 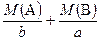

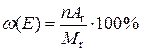 - масова частка елемента в складі сполуки;
- масова частка елемента в складі сполуки;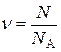 =
= 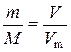 - кількість речовини;
- кількість речовини;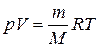 - рівняння Менделєєва-Клапейрона;
- рівняння Менделєєва-Клапейрона;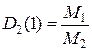 - відносна густина газу 1 за газом 2;
- відносна густина газу 1 за газом 2;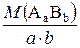 =
= 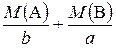 - молярна маса еквівалентів складної речовини;
- молярна маса еквівалентів складної речовини;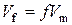 - еквівалентний об’єм;
- еквівалентний об’єм;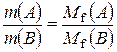 , чи
, чи 


