
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теорія електролітичної дисоціаціїСодержание книги
Поиск на нашем сайте
Закони Рауля і принцип Вант-Гоффа не дійсні для розчинів електролітів (навіть нескінченно розведених). Ці розчини поводять себе так, нібито вони містять більше часток розчиненої речовини, ніж це випливає з їх концентрації. Реальні показники підвищення температури кипіння, зниження температури замерзання, осмотичний тиск цих розчинів завжди більші, ніж розраховані теоретично. Для врахування даних відхилень Вант-Гофф запропонував застосовувати ізотонічний коефіцієнт (і):
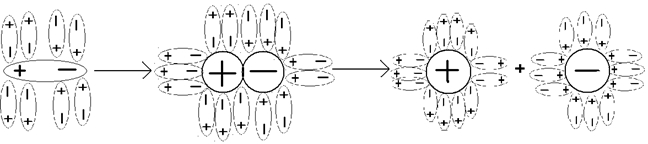
Отже, всі експериментальні значення в i разів більші за теоретичні: P осм. = і CRT; ∆ t кип. = і К е С m; ∆ t зам. = і К к С m. Для неелектролітів і = 1. Для електролітів: NaCl = Na+ + Cl- i =2; CaCl2 = Ca2+ + 2Cl- i =3; AlCl3 = Al3+ + 3Cl- i =4. Експериментально, наприклад, для NaCl 1 < i < 2. Ці факти можна пояснити за допомогою теорії електролітичної дисоціації. Теорія електролітичної дисоціації Арреніуса У 1887 р. учений-хімік Сванте Арреніус зробив такі припущення: 1. Електроліти в розчинах розпадаються на іони − дисоціюють; i вказує, у скільки разів збільшилась загальна кількість частинок у розчині в результаті розпаду на іони молекул. 2. Дисоціація є зворотним рівноважним процесом, електроліти під час розчинення розпадаються на іони не повністю; це пояснює, чому експериментально, наприклад, для NaCl, 1 < i < 2. 3. Сили взаємодії іонів розчиненої речовини з молекулами розчинника слабкі (тобто розчини є ідеальними). Дисоціація – процес розпаду молекул електролітів на позитивно заряджені іони – катіони і негативно заряджені іони – аніони. Електролітична дисоціація речовин, яка відбувається з утворенням вільних іонів, пояснює електричну провідність розчинів. Процес електролітичної дисоціації можна подати у вигляді рівняння KNO3 = K+ + NO3-. Одна молекула дисоціює на два іони. Рівняння дисоціації гідроген хлориду під дією полярного розчинника води таке: HCl + H2O Û H3O+ + Cl-. Іон гідроксонію Але для спрощення запису нехтують водою HCl = H+ + Cl-. Механізм електролітичної дисоціації іонних сполук (іон-дипольний механізм). Орієнтуючись навколо іонів кристалічної решітки натрій хлориду (рис. 20) молекули води утворюють із ними водневі зв’язки, при цьому виділяється велика кількість енергії, яка називається енергією гідратації. Механізм електролітичної дисоціації полярних сполук (диполь – дипольний механізм). Під впливом диполів води поляризований ковалентний зв`язок перетворюється на іонний і молекула гідроген хлориду розпадається на два гідратовані іони (рис. 21).
Рис. 20. Модель дисоціації натрій хлориду під дією полярного розчинника води
Рис. 21. Модель дисоціації гідроген хлориду під дією полярного розчинника води
Концентрації іонів у розчинах слабких електролітів якісно характеризуються ступенем та константою дисоціації. Ступінь дисоціації (α) – відношення числа молекул, які розпалися на іони (n), до загальної кількості розчинених молекул (N): α=n/N.
де k – кількість іонів, на які може розпадатися речовина. Ступінь електролітичної дисоціації виражають у відсотках або частках одиниці. Між недисоційованими молекулами та іонами слабких електролітів через деякий час установлюється динамічна рівновага: NH4OH Û NH4+ + OH-
де К р – константа рівноваги, що відповідає дисоціації слабкого електроліту. Величина константи залежить від природи електроліту і розчинника, температури, але не залежить від концентрації. На рис. 22 наведена класифікація та приклади електролітів. Амфотерні основи можуть дисоціювати за такою схемою: 2H+ + ZnO22− Û Zn(OH)2 Û Zn2+ + 2OH−. Нормальні солі є сильними електролітами, що утворюють у результаті дисоціації катіон металу та аніон кислотного залишку: CuCl2 = Cu2+ + 2Cl-. Кислі солі - сильні електроліти, що утворюють внаслідок дисоціації катіон металу та складний аніон, до складу якого входять іони гідрогену та кислотний залишок: NaHCO3=Na+ + HCO3- α = 1; HCO3- Û H+ + CO3- α < 1.
У розчині − лише іони У розчині є іони й молекули і практично немає молекул
Рис. 22. Класифікація електролітів
Основні солі – електроліти, що утворюють у результаті дисоціації складний катіон, що містить іон металу й гідроксогрупи та аніони кислотного залишку: Fe(OH)2Cl = Fe(OH)2+ + Cl- α = 1; Fe(OH)2+ Û Fe(OH)2+ + OH- α < 1; Fe(OH)2+ Û Fe3+ + OH-.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.82.60 (0.006 с.) |

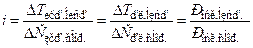 .
.


 Ізотонічний коефіцієнт пов`язаний зі ступенем електролітичної дисоціації:
Ізотонічний коефіцієнт пов`язаний зі ступенем електролітичної дисоціації: i = 1 + α(k - 1 ), або i – 1 = α(k - 1 )
i = 1 + α(k - 1 ), або i – 1 = α(k - 1 ) ,
,



