
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплові ефекти. Внутрішня енергія та ентальпіяСодержание книги
Поиск на нашем сайте
Хімічні реакції відбуваються з виділенням або поглинанням енергії. Енергетичні ефекти в реакціях проявляються в різних формах: тепловій, механічній, електричній, світловій. Так, під час реакцій згоряння речовин енергія виділяється у вигляді теплоти і світла. Прикладом може бути реакція згоряння магнію. Навпаки, реакція термічного розкладу кальцій карбонату на кальцій оксид та карбон(IV) оксид відбувається з поглинанням теплоти, а реакції розкладу аргентум броміду на прості речовини під час фотографічного процесу або фотосинтезу в рослинах – із поглинанням квантів світла. Робота гальванічного елемента або акумулятора є прикладом виділення електричної енергії внаслідок перебігу хімічної реакції, а процеси електролізу навпаки - прикладом її поглинання. У разі вибуху тринітротолуолу (тротилу) або динаміту енергія хімічної реакції виділяється у вигляді механічної роботи й теплоти. Реакції горіння фосфору, сірки, розклад озону відбуваються з виділенням теплоти. Утворення ж озону з кисню, розклад калій перманганату (KMnO4), калій нітрату (KNO3), меркурій(ІІ) оксиду (HgO) потребують затрат енергії. Отже, усі хімічні процеси супроводжуються перетворенням хімічної форми енергії на інші. Для кількісної характеристики енергетики хімічних реакцій різні енергетичні ефекти зводять до одного виду енергії на підставі еквівалентності багатьох її форм відповідно до закону збереження енергії. Теплова форма енергії пов’язана з хаотичним рухом частинок речовин системи, робота ж – зі спрямованим рухом тіл (їх підняття в полі тяжіння), електронів (електричний струм), із розширенням газу тощо. Ця сумарна величина є тепловим ефектом реакції. Тепловим ефектом реакції називають кількість енергії, яка виділяється або поглинається під час перебігу реакції. У міжнародній системі одиниць (СІ) основною одиницею енергії затверджено джоуль (Дж). Для вираження більшої кількості енергії використовують кратну їй одиницю – кілоджоуль (кДж). Енергетичні ефекти реакцій вивчає розділ хімії, що має назву термохімія. Розглянемо причини виникнення теплових ефектів у хімічних реакціях. Відомо, що хімічні перетворення – це руйнування хімічних зв’язків між атомами у вихідних речовинах та утворення нових зв’язків у продуктах реакції. Оскільки енергії хімічних зв’язків у вихідних речовинах і продуктах реакцій неоднакові, різниця енергій виділяється або поглинається у вигляді теплоти. Слід зазначити, що на тепловий ефект реакції впливають також зміна енергії міжмолекулярної взаємодії та деякі інші чинники. Енергії хімічних зв’язків і міжмолекулярної взаємодії є складовими частинами внутрішньої енергії системи. Внутрішня енергія системи (U) – це термодинамічна функція, яка дорівнює сумі кінетичної і потенціальної енергії всіх часток у системі. Кінетична енергія – це енергія, пов’язана з рухом тіл. Потенціальна енергія – це енергія положення, яка залежить від розташування тіл. Хімічна система може складатися з атомів, молекул, іонів чи будь-якої їх комбінації. Усі частинки мають кінетичну й потенціальну енергію. Кінетична енергія зумовлена рухом часток: поступальним, коливальним, обертовим. Потенціальна енергія часток зумовлена електростатичними силами притягання між частками і всередині них. Абсолютна величина внутрішньої енергії невідома, можна визначити тільки її зміну, тобто різницю між кінцевим і початковим станом системи, які позначатимемо відповідно індексами “2” і “1”: D U = U 2 – U 1. (13) Пригадаємо закон збереження енергії, який ще називають першим законом термодинаміки: в усіх процесах, які відбуваються в навколишньому світі, енергія не виникає і не зникає, вона передається від одного об’єкта до іншого або перетворюється з однієї форми на іншу. Відповідно до закону внутрішня енергія системи U залишається сталою, якщо не відбувається тепловий обмін між системою і навколишнім середовищем (D U = 0). У разі підведення до системи теплоти Q вона витрачатиметься на зміну внутрішньої енергії системи й роботу проти зовнішніх сил: Q = D U + A. (14) Рівняння (14) є математичним виразом першого закону термодинаміки. Для наочного уявлення фізичного змісту цього рівняння розглянемо систему, що є газом, який міститься в циліндрі, закритому поршнем (рис. 14). Якщо поршень закріпити нерухомо, то об’єм системи не змінюватиметься, робота розширення А дорівнюватиме нулю і вся підведена до системи теплота Q v за сталого об’єму витрачатиметься на збільшення внутрішньої енергії: Q v = D U. (15) Якщо до системи підводити теплоту (Q p) за сталого тиску й надати змогу поршню вільно рухатись, то під час розширення система виконає роботу:
де F – сила, що діє на поршень; h – висота переміщення поршня; Р – тиск; S – площа поршня. Оскільки Sh дорівнює зміні об’єму системи D V, то A = P D V = P (V 2 – V 1). (17) У цьому разі рівняння (14) набуває вигляду Q p=D U + P (V 2– V 1)= U 2– U 1+ P (V 2– V 1)= = (U 2+ PV 2)–(U1+PV1). (18)
H = U + PV. (19) Тоді з рівнянь (18) і (19) маємо: Q p = H 2 – H 1 = D H. (20) Отже, зміна ентальпії системи відповідає тепловому ефекту реакції, виміряному за умов сталих тиску й температури. В екзотермічних процесах теплота виділяється за рахунок зменшення внутрішньої енергії системи, отже, U 2< U 1, D U <0. (21) Аналогічно для процесів, які відбуваються за сталого тиску, маємо Н 2< Н 1, D Н <0. (22) Навпаки, в ендотермічних процесах система поглинає теплоту, запас її енергії зростає і тому U 2 > U 1, D U >0. (23) Н 2 > Н 1, D Н >0. Оскільки переважна більшість хімічних реакцій відбувається саме за сталого тиску (у відкритій колбі), то для характеристики енергетичних ефектів застосовують зміну ентальпії D Н. Рівняння хімічних реакцій, у яких указаний тепловий ефект, називають термохімічними. Значення теплового ефекту пов’язують із тим числом молів реагуючих речовин і продуктів реакції, яке відповідає стехіометричним коефіцієнтам. Теплові ефекти залежать від агрегатного стану речовин і умов, за яких відбувається реакція. Саме тому в термохімічних рівняннях зазначають агрегатний стан речовин; якщо це спеціально не зазначено, то теплові ефекти вказані для стандартних умов. Стандартними умовами вважають температуру 298 К і парціальний тиск газоподібних речовин 101, 3 кПа, для розчинів – концентрацію 1 моль/л. Наприклад: 2H2(г) + О2(г) = 2Н2О(р), D Н =-571,66 кДж/моль. Перший закон термохімії сформулювали Лавуазьє та Лаплас: теплота розкладу певної сполуки чисельно дорівнює теплоті її утворення, але має протилежний знак.
Суть закону Гесса продемонструємо на прикладі реакції вуглецю з киснем, яка може відбуватися різними шляхами. Перший шлях: C(графіт)+1/2O2(г)=СО(г), DН1= –110,5 кДж/моль, (24) СО(г)+1/2O2(г)=СО2(г), D Н 1= –283,0 кДж/моль. (25) Другий шлях: C(графіт)+O2(г)=СО2(г), D Н 3= –393,5 кДж/моль. (26)
лові ефекти, що відповідають стадіям І способу, одержимо такий самий тепловий ефект, як за ІІ способом проведення процесу. При цьому очевидно, що в результаті додавання рівнянь (24) і (25) матимемо сумарну реакцію утворення СО2 - рівняння (26). У зв’язку з цим можна сформулювати такі наслідки закону Гесса.
|
||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 274; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.009 с.) |

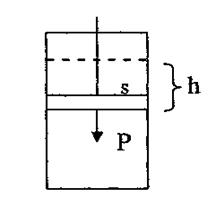 A = Fh = PSh, (16)
A = Fh = PSh, (16) Другий закон термохімії відкрив російський вчений Герман Іванович Гесс у 1840 р.: тепловий ефект хімічної реакції залежить від виду і стану реагуючих речовин і продуктів реакції, але не залежить від шляху (проміжних стадій), за яким відбувається процес.
Другий закон термохімії відкрив російський вчений Герман Іванович Гесс у 1840 р.: тепловий ефект хімічної реакції залежить від виду і стану реагуючих речовин і продуктів реакції, але не залежить від шляху (проміжних стадій), за яким відбувається процес.


