
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приклади розв’язування задач (до розділу 4. 3)Содержание книги
Поиск на нашем сайте
1. Розрахувати р Н середовища для водного розчину натрій хлориду. Розв’язання Солі, утворені катіоном та аніоном сильних електролітів гідролізу не підлягають.
Сутність реакції – дисоціація води, порушення рівноваги між іонами Гідрогену та гідроксилу немає. Відповідь: р Н водного розчину натрій хлориду має нейтральне значення. 2. Розрахувати р Н середовища під час взаємодії з водою калій ацетату і натрій карбонату. Розв’язання Ці солі, утворені сильною основою та слабкою кислотою. а) Гідроліз відбувається за аніоном:
Запишемо повне іонно-молекулярне рівняння:
та молекулярне рівняння:
б) Натрій карбонат утворений сильною основою (NaOH) та слабкою кислотою (H2CO3). Гідроліз відбувається за аніоном, а реакція середовища визначатиметься за сильним компонентом (у даному випадку вона буде лужною):
Зі скороченого рівняння першої стадії гідролізу одержимо повне іонно-молекулярне рівняння:
та молекулярне рівняння:
Оскільки в результаті гідролізу утворилася кисла сіль, вона також підлягає подальшому гідролізу за другою стадією:
Таким чином, якщо сіль утворена сильною основою і слабкою Під час гідролізу карбонат-іона як продукт реакції утворюються іони гідроксиду, накопичення яких згідно з принципом Ле Шательє повинно запобігати гідролізу. Тому за наявності лугів гідроліз натрій карбонату пригнічується, а в кислому середовищі відбувається зв’язування іонів гідроксиду і гідроліз підсилюється. 3. Розрахувати р Н середовища під час взаємодії з водою амоній хлориду та алюміній сульфату. Розв’язання Ці солі, утворені слабкою основою та сильною кислотою. а) Амоній хлорид утворений слабкою основою NH4OH та сильною кислотою HCl. Сіль розчинна, тобто може дисоціювати у водному розчині:
Гідроліз відбувається за катіоном, середовище визначається сильним компонентом, тому буде кислим.
б) Запишемо дисоціацію алюміній хлориду:
Гідроліз за катіоном. Якщо основа слабка та багатокислотна, гідроліз повинен здійснюватися поступово. Кількість його стадій дорівнює кислотності основи. У даному випадку можливі три стадії. Але самовільний гідроліз можливий тільки в першій, інші − відбуваються тільки за певних умов:
ІІ стадія гідролізу можлива тільки в разі розведення та нагрівання:
ІІІ стадія гідролізу можлива лише в тому випадку, коли до киплячої води додають краплями розчин алюміній хлориду: Al(OH)2+ + HOH Û Al(OH)3 + H+;
Розглянемо ще гідроліз солі хром (ІІІ) сульфату:
І стадія:
ІІ стадія:
ІІІ стадія:
4. Розрахувати р Н середовища під час взаємодії з водою амоній ціаніду. Розв’язання Ця сіль утворена катіоном та аніоном слабких електролітів, тому реакція середовища визначається співвідношенням сили слабких електролітів, що утворюються.
р Н > 7, оскільки К д (NH4OH)=1,76∙10-5, а К д (HCN)=7,2∙10-10. Середовище може наближатися до нейтрального, якщо константи дисоціації слабкої кислоти та основи близькі за значенням. Ще одним прикладом можливого перебігу реакції в розчинах солей, утворених частинками слабких електролітів, є так зване підсилення гідролізу. Цей тип гідролізу ускладнює реакції обміну між солями. Солі, які не належать до важкорозчинних і утворені аніоном та катіоном дуже слабких багатоосновних кислот та багатокислотних основ, не можна отримати реакцією обміну у зв’язку з їх глибоким гідролізом, який часто відбувається до кінця. Наприклад, сіль алюміній сульфід можна отримати спіканням алюмінію із сіркою. У таблиці розчинності цієї солі немає, оскільки під час розчинення відбувається її повний гідроліз. За рахунок останнього іон Алюмінію зв’язує іони гідроксилу, а сульфід-іон – іони Гідрогену. У результаті в надлишку не накопичуються ні іони ОН- , ні іони Н+, гідроліз не закінчується на перших стадіях, а відбувається далі – до утворення кінцевих продуктів.
5. Визначити р Н середовища під час взаємодії з водою натрій гідрокарбонату. Розв’язання Реакція гідролізу кислих солей багатоосновних слабких кислот може бути як кислою, так і слабколужною. Гідроліз натрій гідрокарбонату: NaHCO3 + H2O Û H2CO3 + NaOH, HCO3- + H2O Û H2CO3 + OH-. Особливість гідролізу солей такого типу полягає в тому, що одночасно із зазначеною реакцією гідролізу відбувається також реакція дисоціації аніона кислої солі, яка обумовлює утворення в розчині іонів Н+:
які нейтралізують іони гідроксилу.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 212; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.197.111 (0.005 с.) |

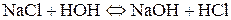 .
.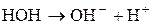 .
.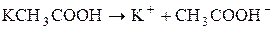 .
.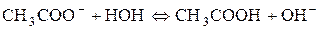 − середовище лужне.
− середовище лужне.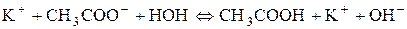 .
.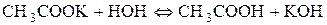
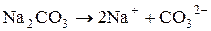 .
.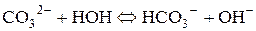 .
.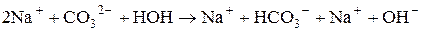
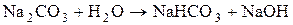 .
.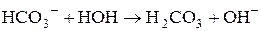 ,
,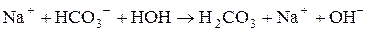 ,
, .
.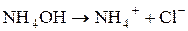 .
.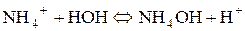 ;
;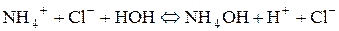 ;
;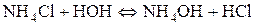 .
.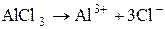 .
.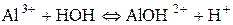 ;
;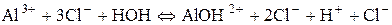 ;
;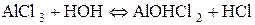 .
.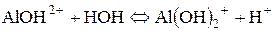 ;
;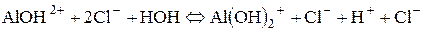 ;
;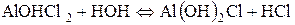 .
.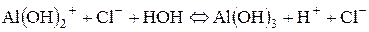 ;
;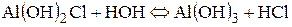 .
.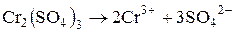 .
.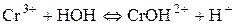 ;
;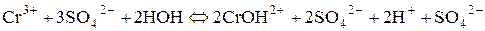 ;
;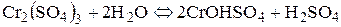 .
.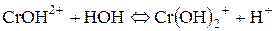 ;
;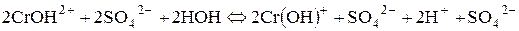 ;
;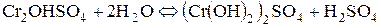 .
.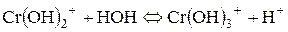 ;
;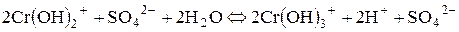 ;
;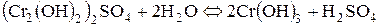 /
/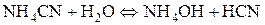 ,
,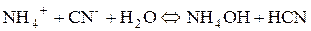 ,
,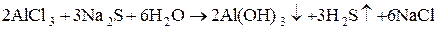 ,
,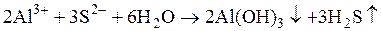 .
.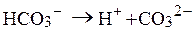 ,
,


