
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приклади розв’язування задач (до розділу 4. 1-4. 2)Содержание книги
Поиск на нашем сайте
1. Потрібно приготувати розчин масою 500 г із масовою часткою калій хлориду 14%. Визначити необхідні маси солі та води.
Розв’язання
Таким чином, для приготування розчину треба взяти 70 г KCl і 430 г води. 2.Обчислити масу цинк хлориду, потрібну для приготування 250 мл його децинормального розчину. Розв’язання
Підставимо в одержану формулу значення
тоді звідси Таким чином, маса цинк хлориду 1,7 г.
У задачах часто розглядають змішування декількох розчинів однієї У процесі розв’язання задач даного типу, в алгебричних рівняннях застосовується закон збереження маси речовин. У рівнянні вказується, що маса розчиненої речовини під час змішування розчинів не змінилася. Її масу подають як добуток маси розчину і масової частки розчиненої речовини, вираженої десятковим дробом: m 1 + m2 = (m1 + m2)w. Одна з величин, наявних у рівнянні, звичайно є невідомою, її необхідно знайти. Серед компонентів, які змішуються, може бути чистий розчинник (його розглядають як розчин із концентрацією, що дорівнює нулю, тобто w = 0) і суха речовина без розчинника (його розглядають як розчин зі стопроцентною концентрацією, тобто w = 1). 3.Визначити, у якій кількості розчину з масовою часткою глюкози 5% необхідно розчинити її 120 г, щоб отримати розчин із масовою часткою глюкози 8%. Розв’язання Шукана величина х – маса розчину з масовою часткою глюкози 5%. В алгебричному рівнянні запишемо, що маса глюкози в утвореному розчині дорівнює її масі, яка міститься в х г розчину з ω = 5% плюс 120 г, що розчинили в останньому. Маса розчину, що утворився, дорівнює (х+120) г і в ньому міститься (х+120)∙0,08 г глюкози. У х г розчину з масовою часткою глюкози 5% знаходиться 0,05 г глюкози. Схема зміни кількісного складу розчину під час розчинення глюкози така:
+ ® Отже, (х+120)∙0,08 = 0,05х + 120, звідси х = 3 680. Таким чином, глюкозу необхідно розчинити в 3 680 г розчину з масовою часткою глюкози 5%. 4.Визначити молярну та нормальну концентрації розчину сульфатної кислоти з масовою часткою H2SO4 14% (густина 1,57 г/мл). Розв’язання Молярну концентрацію визначають за формулою
Виразимо C через дані умови задачі, застосовуючи такі залежності:
Оскільки де то За умовою задачі Аналогічно знаходимо нормальну концентрацію
Тоді
Таким чином, молярна концентрація H2SO4 - 2,2 моль/л, нормальна кон-центрація − 4,4 моль/л. 5. До розчину масою 80 г із масовою часткою натрій нітрату 12% додали воду масою 170 г. Розрахувати масову частку нітрату в одержаному розчині. Розв’язання
1) 2) 3) Таким чином, масова частка натрій нітрату дорівнює 3,84%. 6. Знайти маси розчинів натрій хлориду з масовими частками 10% та 20%, необхідні для приготування 300 г розчину з масовою часткою 12%. У відповіді вказати масу розчину з масовою часткою 10%. Задачі про змішування розчинів із різними масовими частками для приготування розчину із заданою масовою часткою можна розв’язувати, застосовуючи правило змішування (або правило хреста). Розв’язання
2)
3) аналогічно Відповідь: маса розчину з 6. До розчину, який містить хлорид і карбонат натрію масою 22,3 г, додали надлишок розчину хлоридної кислоти. Після закінчення реакції розчин випарили. Маса твердого залишку 23,4 г. Обчислити масову частку (у відсотках) натрій хлориду у вихідній суміші. Розв’язання Складемо рівняння хімічної реакції:
Na2CO3 + 2HCl ® 2NaCl + CO2 + H2O 106 г/моль 2×58,5 г/моль Позначимо кількість речовини натрій хлориду у вихідній речовині через х, а натрій карбонату – через у моль. Відповідно до умови задачі масу вихідної суміші можна записати в такому вигляді: 58,5х + 106у = 22,3. Обчислимо кількість речовини натрій хлориду (твердий залишок), що утворився після випарювання розчину:
Відповідно до рівняння реакції тоді Згідно з умовою задачі кількість речовини твердого залишку є сумою кількості речовини натрій хлориду, що входить до складу вихідної суміші, і кількості речовини натрій хлориду, що утворився в результаті реакції: х + 2у = 0,4. Складемо систему рівнянь і розв’яжемо її:
х+2у=0,4, звідки х = 0,2; у = 0,1. Розрахуємо масову частку натрій хлориду у вихідній суміші так:
8. Визначити концентрацію іонів малорозчинного електроліту в його насиченому розчині. Добуток розчинності BaF2 при 18ºC дорівнює1,7∙10−6. Розрахувати концентрацію іонів Ba2+ та F− у насиченому розчині BaF2 за цієї температури. Розв’язання BaF2 розпадається за рівнянням BaF2 ↔ Ba2+ + 2F−. У процесі дисоціації BaF2 іонів F− одержується в 2 рази більше, ніж іонів Ba2+. Отже, [F−] = 2[Ba2+]. Добуток розчинності солі ДР BaF2 =[Ba2+] [F−]2. Якщо виразити концентрацію іонів F− через концентрацію іонів Ba2+, то ДР BaF2 = [Ba2+] (2[Ba2+])2= 4 [Ba2+]3 = 1,7∙10−6. Концентрація іонів Ba2+ дорівнює
Концентрація іонів F− дорівнює F− = 7,5∙10−3∙2 = 1,5∙10−3 (моль/л). 9. Визначити рН та рОН децимолярного розчину нітратної кислоти. Розв’язання Нітратна кислота – сильний електроліт. Тому [H+] = C(HNO3) = 0,1 моль/л; р Н = − lg 0,1 = 1; p OH = 14 − 1 = 13.
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 295; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.112.208 (0.007 с.) |

 ;
; ;
;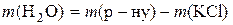 ;
;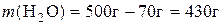 .
. .
.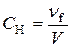 .
.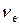 :
: ,
,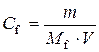 ,
,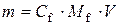 .
.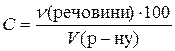 .
. ;
;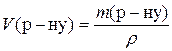 ;
; ,
,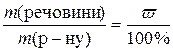 ,
, .
. .
. , де
, де  .
. ; f (H2SO4)=1/2;
; f (H2SO4)=1/2; .
.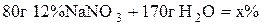 ;
; ;
; ;
;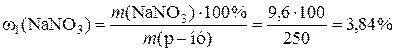 ;
;
 1)
1) 

 ;
; .
. дорівнює 240 г, маса розчину
дорівнює 240 г, маса розчину  становить 60 г.
становить 60 г.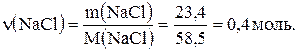
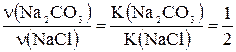 ,
,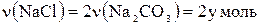 .
. 58,5х+106у=22,3,
58,5х+106у=22,3, Відповідь: масова частка натрій хлориду у вихідній суміші 52,5%.
Відповідь: масова частка натрій хлориду у вихідній суміші 52,5%. .
.


