Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні поняття та закони хіміїСодержание книги
Поиск на нашем сайте
Ключові положення атомно-молекулярного вчення 1.Речовини мають дискретну будову. Вони складаються з часток (структурних елементів – молекул, атомів чи іонів). 2.Частки речовини безперервно безладно рухаються. 3.Між складовими частками речовини діють сили взаємного притягання і відштовхування. 4.Між складовими частками речовини є проміжки. 5.Молекули складаються з атомів. 6.Молекули зберігаються під час фізичних явищ і руйнуються під час хімічних. 7.Атоми зберігаються під час хімічних реакцій – при цьому відбувається їх перегрупування, що зумовлює утворення нових речовин. 8.Різноманітність речовин пов’язана з різним сполученням атомів. Поняття загальної хімії Ключовими поняттями хімії є молекула, атом, хімічний елемент, речовина. Молекула (від латин. moles – маса) - це здатна до самостійного існування найменша частка речовини, яка зберігає властивості цієї речовини. Атом (від грец. atomos – неподільний) – це хімічно неподільна електронейтральна частка речовини, що складається з позитивно зарядженого ядра й негативно заряджених електронів. Хімічний елемент – це сукупність атомів з однаковими зарядами ядер. Речовина – це вид матерії, що характеризується певними фізичними та хімічними властивостями за даних умов. Фізичні величини, що застосовуються в хімії Оскільки абсолютні значення мас атомів і молекул є дуже малими величинами, то ними дуже незручно користуватися під час хімічних розрахунків. З огляду на це виникла необхідність ввести їх відносні значення. Відносна атомна маса хімічного елемента (А r) – це фізична величина, яка визначається відношенням маси атома (m a) елемента до однієї дванадцятої частки маси атома ізотопу Карбону С12:
Відносна молекулярна маса (М r) – це фізична величина, яка визначається відношенням маси молекули (m m) до однієї дванадцятої частки маси атома ізотопу Карбону С12:
Відносну молекулярну масу можна обчислити як суму відносних атомних мас усіх елементів, що входять до складу молекули: M r = n 1 A r¢ + n 2 A r¢¢ + … + nA r. Масова частка елемента, що входить до складу молекули, визначається за формулою
Кількість речовини (n) – це фізична величина, яка визначається числом часток – структурних елементів речовини: молекул, атомів, іонів, іонних асоціатів.
Кількість речовини обчислюється співвідношенням
де N – число структурних елементів у певній порції речовини. Якщо N = N A, то n=1. Ця одиниця в Міжнародній системі одиниць вимірювання має назву моль. Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону С12 масою 0,012 кг. Число атомів чи молекул, що містяться в речовині кількістю 1 моль, називають сталою Авогадро:
Молярна маса (М) – маса речовини кількістю 1 моль:
M r і М однакові за величиною, однак молярна маса порівняно з відносною молекулярною масою має розмірність. Якщо n = 1 моль, то маса речовини дорівнює молярній масі m = M, а якщо збільшити n, то в стільки ж разів збільшиться і маса речовини m, тобто m = n×M, чи n = m/M. Для газоподібних речовин важливою величиною є молярний об’єм. Молярний об’єм – це об’єм газоподібної речовини кількістю 1 моль. За нормальних умов (Р =101,3 кПа, t =0°C чи Т =273 К) молярний об’єм будь-якої газоподібної речовини дорівнює V M=22,4 л/моль. Таким чином, кількість речовини можна визначити за формулою n = V/V M.
Основні закони хімії були відкриті наприкінці XVIII – на початку XIX ст. і послужили базою для перетворення хімії на науку, що застосовує математичні методи.
маса речовин, що вступають у хімічну реакцію, дорівнює загальній масі речовин, що утворюються в результаті реакції. Якщо хімічну реакцію зобразити в загальному вигляді А + B = C + D, то закон можна записати так: m(A + B) = m(C + D). Наприклад: 2H2 + O2 = 2H2O 2×2 32 2×18.
36 36 2.Закон cталості складу сформулював у 1808 р. Пруст:
|
|||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.255.110 (0.008 с.) |

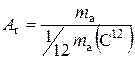 .
.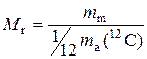 .
.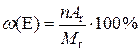 .
.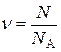 ,
,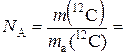
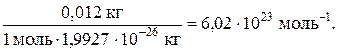
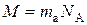 , г/моль.
, г/моль.
 1.1.4. Основні закони хімії
1.1.4. Основні закони хімії