
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Та її експериментальне доведенняСодержание книги
Поиск на нашем сайте
Наприкінці ХІХ ст. завдяки працям цілого ряду вчених було встановлено, що атом подільний і є складною системою. Найважливішими експериментальними фактами, які лягли в основу створення теорії атома, є відкриття електронів і явища радіоактивності. Перші дані про складність будови атома було одержано в процесі вивчення катодного випромінювання, що утворюється внаслідок проходження електричного струму через розріджені гази. Катодне випромінювання виникає в скляній посудині, з якої вилучене повітря і в яку впаяні металеві катод і анод (рис. 5). Якщо приєднати ці електроди до джерела струму високої напруги і ввімкнути струм, то катод почне випускати невидиме для ока проміння, яке викликає блакитне світіння (люмінесценцію) скла. Це світіння не залежить від природи катода. Створення додаткового електричного поля на шляху проміння переміщує блакитне світіння в бік позитивного полюса зовнішнього поля. Аналогічне відхилення спостерігається в магнітному полі. Було встановлено, якщо всередині трубки помістити перепону, то в області відсвічування з’явиться її тінь. На основі цих фактів англійський фізик В. Крукс у 1880 р. висловив припущення, що катодне випромінювання є потоком негативно заряджених частинок, які дуже швидко рухаються.
Вивчення катодного випромінювання вимірюванням його відхилення в електричному й магнітному полях показало, що це потік найдрібніших частинок, які несуть найменший електричний заряд. Ці частинки було названо електронами, обчислено заряд електрона - 1,602×10-19 Кл, відношення заряду до маси, а потім і його масу - 9,1094×10-28 г. Вільні електрони утворюються не лише під час проходження електричного струму крізь розріджені гази, а й під час прожарювання металів, опромінювання їх ультрафіолетом. Усе це є доказом того, що електрони входять до складу речовин і можуть відриватись від них за певних умов. Велику роль у встановленні складної природи атомів відіграло відкриття і вивчення радіоактивності. Французький фізик Беккерель (1896) помітив, що сіль Урану діє на фотографічну пластинку без попереднього її освітлення. Крім того, він визначив, що сполуки Урану виділяють невидиме проміння, яке обумовлює почорніння фотографічної пластинки, проходячи не тільки крізь чорний папір, а й крізь дерево, тонкі пластинки металу. Дослідами Беккереля зацікавились різні вчені. Зокрема, М. Склодовська-Кюрі встановила, що подібно до сполук Урану на фотопластинку діє Торій. У 1898 р. М.Склодовська-Кюрі та її чоловік П.Кюрі виявили в урановій руді ще два елементи, з такими ж властивостями - Полоній і Радій. Здатність деяких елементів виділяти невидиме для ока проміння, яке викликає почорніння фотографічних пластинок, проходить крізь речовини, іонізує повітря, називається радіоактивністю, а відповідні елементи – радіоактивними. Досліди показали, що радіоактивність препарату визначається лише вмістом радіоактивного елемента і не залежить від природи сполуки й зовнішніх умов. Усі ці факти свідчать про те, що радіоактивність зумовлена самовільним розпадом атомів радіоактивних елементів.
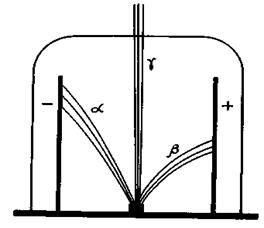 суть електричного заряду, назвали g-променями. Ці жорсткі електромагнітні коливання, подібні до рентгенівських променів, мають дуже велику проникну здатність. Промені, які відхиляються до позитивного полюса (b-промені), складаються з негативно заряджених частинок дуже малої маси – електронів. Промені, які відхиляються до негативного полюса (a-промені), є частинками суть електричного заряду, назвали g-променями. Ці жорсткі електромагнітні коливання, подібні до рентгенівських променів, мають дуже велику проникну здатність. Промені, які відхиляються до позитивного полюса (b-промені), складаються з негативно заряджених частинок дуже малої маси – електронів. Промені, які відхиляються до негативного полюса (a-промені), є частинками
значної маси із позитивним зарядом – ядра атома Гелію. Перші моделі атома
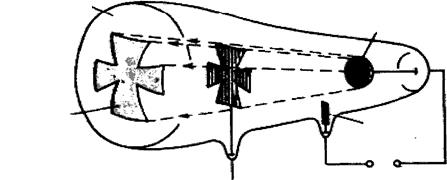
негативно заряджені електрони. Виходячи з розміщення елементів у періодичній системі Д.І.Менделєєва і періодичної зміни їх хімічних властивостей Томсон припустив, що електрони в атомі розміщуються пошарово й хімічні властивості елементів зумовлені зовнішнім шаром електронів. Така модель атома трактувала тільки деякі його властивості (випромінювання, розсіювання, поглинання світла). Багато експериментальних даних, зокрема досліди Резерфорда, модель Томсона пояснити не могла. Для перевірки цієї моделі та більш точного визначення внутрішньої будови атома Резерфорд провів серію дослідів з a-частинками, які утворюються в результаті радіоактивного розпаду. Він спрямував a-частинки, спостерігаючи за їх рухом, на тоненькі металеві пластинки (рис. 7). Учений встановив, що переважна більшість a-частинок проникала крізь металеві пластинки, деякі з них відхилялись під кутом від прямолінійного напряму руху і тільки незначна кількість (1 частинка із 10 000) була відкинута у вихідне положення. Проходження a-частинок через металеву пластинку і відкидання від неї неможливо пояснити з позиції моделі атома Томсона. Справді, a-частинка, яка має подвійний позитивний заряд і значну масу, під час її швидкого руху може бути відкинута у вихідне положення лише тоді, коли зіткнеться зі значно більшим позитивним зарядом. Крім того, проходження великої кількості a-частинок крізь металеву пластинку є доказом того, що атом майже “порожній” і має дискретну будову.
Рис. 7. Схема досліду Резерфорда: 1 – свинцева скринька; 2 – препарат Радію; 3 – пучок a-частинок; 4 – екран; 5 – проміння a-частинок, що відхилилися на невеликі кути або різко змінили напрям руху; 6 – тонка металева пластинка; 7 – a-частинки, які не змінили свій напрямок
На основі своїх дослідів Резерфорд у 1911 р. запропонував ядерну модель атома. Відповідно до неї в центрі атома міститься позитивно заряджене ядро, маса якого майже дорівнює масі атома, навколо ядра рухаються електрони, число яких дорівнює позитивному заряду ядра. Між ядром і електронами взаємодіють електростатичні (кулонівські) сили, зрівноважені відцентровою силою, що виникає внаслідок руху електронів. Якщо сила кулонівського притягання до ядра дорівнює
де m – маса електрона; v – швидкість руху електрона; e – заряд електрона; r – радіус орбіталі, по якій рухається електрон. Досліди з a-частинками дали змогу Резерфорду оцінити величину заряду ядер різних атомів. Результати обчислень показали, що заряд ядра атома чисельно дорівнює порядковому номеру елемента в періодичній системі. Атоми елементів нейтральні, а тому кількість електронів у кожному з них також дорівнює відповідному порядковому номеру елемента. Велике значення у встановленні заряду ядра атома мали дослідження учня Резерфорда англійського фізика Мозлі. Атомні спектри Ядерна модель атома Резерфорда, підтверджена великою кількістю експериментальних даних, була значним кроком уперед у процесі пізнання будови атома, проте вона не могла пояснити деякі факти. Відомо, якщо сонячний промінь пропустити крізь призму, він розкладається, і на екрані, поставленому за призмою, з’являється кольорова смуга, яка містить усі кольори райдуги в безперервній послідовності. Це пояснюється тим, що білий промінь складається з електромагнітних хвиль різної довжини, які, проходячи крізь призму, неоднаково нею заломлюються і потрапляють на різні місця екрана. Такий спектр називається суцільним. Його утворюють нагріті до високої температури тверді тіла або рідини. Світло, яке випромінюється розжареним газом або парою, складається з електромагнітних хвиль певної довжини, тому замість суцільної кольорової смуги на екрані з’являється ряд окремих кольорових ліній, розділених темними проміжками. Так, у видимій частині спектра Гідрогену містяться п’ять ліній: червона, зелена, синя і дві фіолетові (рис. 8).
Рис. 8. Схема атомного спектра Гідрогену у видимій області
Такі спектри називають лінійчастими (атомними). Експериментально встановлено, що кожному хімічному елементу відповідає свій атомний спектр, який відрізняється від спектрів інших елементів. Модель атома Резерфорда не могла пояснити походження лінійчастих спектрів. Більше того, вона їм суперечила. Справді, за законом класичної електродинаміки електрон, який обертається навколо ядра, повинен безперервно випромінювати електромагнітну енергію у вигляді світлових хвиль, за рахунок чого швидкість його руху весь час зменшуватиметься, а електрон “впаде” на ядро, що призведе до припинення існування атома. Це не збігається з реальними властивостями атомів, які є стійкими утвореннями і можуть існувати без руйнування нескінченно довго. Крім того, у разі безперервного випромінювання енергії електроном спектр атома має бути безперервним, суцільним, а він лінійчастий. Також модель атома Резерфорда не змогла пояснити існування стійких атомів. Квантова теорія світла У 1900 р. німецький фізик Макс Планк, вивчаючи природу випромінювання нагрітих твердих тіл, висловив припущення, що енергія випромінюється і поглинається не безперервно, а дискретно, певними частинами – квантами, пропорційними частоті коливань. Величину кванта енергії можна обчислити зі співвідношення, яке називається рівнянням Планка:
де Е – кількість енергії з частотою коливань n; h – константа пропорційності, або універсальна стала Планка, що дорівнює 6,626 × 10-34 Дж×с. Із рівняння видно, що енергія кванта тим більша, чим більша частота коливань або чим менша довжина хвилі. Постулат Планка був обґрунтований Ейнштейном (1905). Аналізуючи явище фотоелектричного ефекту, тобто здатності металів випромінювати електрони під дією світла, він дійшов висновку, що електромагнітна (промениста) енергія існує лише у формі квантів і випромінювання є потоком неподільних матеріальних частинок (фотонів), енергія яких визначається за рівнянням Планка. Із погляду класичної механіки обертання електрона з масою m навколо ядра атома визначається моментом кількості руху, тобто добутком m v r, де r – радіус кола; v – швидкість руху електрона. Припускається, що величини r і vможуть змінюватись як завгодно і безперервно. У квантовій механіці енергія електрона, що рухається, може змінюватись тільки квантами. Це означає, що величини r і v, від яких залежать величина енергії і момент кількості руху m v r, також мають змінюватись стрибкоподібно. У квантовій механіці момент кількості руху виражається співвідношенням h/2p і може дорівнювати h/2pn, де n = 1,2,3,4,..., тобто будь-якому цілому числу
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 202; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.107.243 (0.009 с.) |

 У ході вивчення катодного випромінювання і радіоактивності виявилося, що до складу атомів елементів входять електрони. Оскільки атоми електронейтральні, то вони повинні мати стільки позитивних зарядів, скільки міститься в них електронів. З’ясуємо, як же розміщуються в атомі електрони й позитивні заряди.
У ході вивчення катодного випромінювання і радіоактивності виявилося, що до складу атомів елементів входять електрони. Оскільки атоми електронейтральні, то вони повинні мати стільки позитивних зарядів, скільки міститься в них електронів. З’ясуємо, як же розміщуються в атомі електрони й позитивні заряди.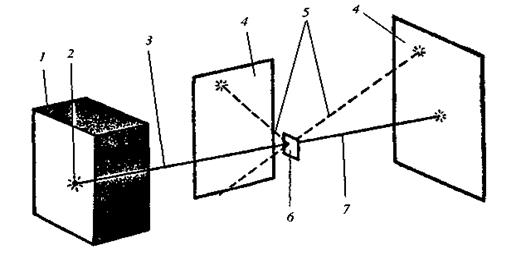
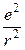 , а відцентрова сила
, а відцентрова сила 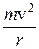 , то
, то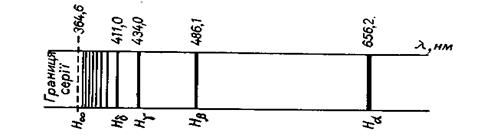
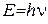 ,(3)
,(3)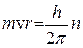 . (4)
. (4)


