
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Залежність швидкості реакції від концентраціїСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реагуючих речовин - закон діючих мас Необхідною умовою перебігу хімічної реакції між двома речовинами є зіткнення їх молекул. Швидкість хімічної реакції залежить від числа таких зіткнень в одиниці об’єму. Ймовірність зіткнення взаємодіючих молекул для гомогенної реакції пропорційна концентраціям реагуючих речовин. Таким чином, швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції. Ця закономірність була встановлена експериментально в 1867 р. Гульбер- бергом і Вааге і називається законом діючих мас (ЗДМ). Діючими масами на той час називали концентрації речовин. Для взаємодії двох молекул, наприклад водню та йоду, за рівнянням Н2 + I2 = 2HI, в елементарному акті якої беруть участь по одній молекулі, ЗДМ у математичній формі має такий вигляд: v = kC (H2) C (I2).
Для реакції 2NO + Cl2 = 2NOCl швидкість v = kC 2(NO) C (I2). Для загальної реакції a A + b B = c C + d D швидкість дорівнює v = kC a(A) C b(B) = k [A]a[B]b. Величина k – коефіцієнт пропорційності між швидкістю і концентрацією - називається константою швидкості реакції. Вона чисельно дорівнює швидкості реакції, якщо концентрація відповідних речовин дорівнює одиниці. Константа швидкості за сталої температури величина стала і характеризує природу реагуючих речовин. Константа швидкості дорівнюєшвидкості реакції за умови, що концентрації реагуючих речовин становлять 1 моль/л. Рівняння, що пов’язує швидкість реакції з концентраціями реагентів, називають рівнянням швидкості або кінетичним рівнянням реакції. Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники степеня в законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер. Розглянемо простий приклад. Фотохімічний розклад газоподібного НBr відбувається за стехіометричним рівнянням 2HBr(г) = Н2(г) + Br2(г). Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул HBr. Насправді дана фотохімічна реакція здійснюється таким чином: HBr + hv = H + Br; H + HBr = H2 + Br; Br + Br = Br2. Отже, ніякого зв’язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками степенів у кінетичному рівнянні, зовсім немає. Схожість, що спостерігається для деяких реакцій, має ви-падковий характер. Перебіг більшості хімічних реакцій полягає в тому, що утворення продуктів відбувається через ряд проміжних елементарних стадій (послідовних чи пара-лельних), які можна вважати елементарними реакціями. Кожна з цих реакцій описується кінетичним рівнянням. У таких випадках залежність швидкості від концентрації може виявитися дуже складною. Ситуація спрощується, коли яка-небудь із цих стадій відбувається набагато повільніше інших. Тоді набуває чинності один із найважливіших принципів кінетики – принцип лімітуючої стадії: швидкість складної реакції визначається швидкістю найповільнішої (лімітуючої) елементарної стадії. Сума показників степенів у рівнянні швидкості хімічної реакції (кінетичному рівнянні) є важливою характеристикою механізму процесу й називається порядком хімічної реакції. Окремі показники ступенів концентрацій реагентів визначають порядок реакції щодо даної речовини. Елементарний акт реакції відбувається внаслідок зіткнення молекул. Для характеристики механізму реакцій застосовують поняття молекулярності реакції. Число молекул, які беруть участь в елементарному акті реакції, називають молекулярністю реакції. Реакція, для перебігу якої необхідна тільки одна молекула, називається мономолекулярною реакцією. Це реакція розкладу чи перегрупування, наприклад: I2 = 2I; N2O5 = 2NO2 + 1/2O2. Для елементарного акту бімолекулярної реакції потрібна наявність двох часток (молекул, іонів, атомів): H2 + I2 = 2HI. У ході тримолекулярної реакції взаємодіють одночасно три молекули (такі реакції спостерігаються дуже рідко): 2NO + O2 = 2NO2. Реакцій, молекулярність яких більше трьох, не буває, оскільки одночасне зіткнення в одній точці чотирьох і більше молекул малоймовірне. Фактично всі реальні хімічні реакції дуже прості, не враховуючи іноді складних сумарних стехіометричних рівнянь. Таким чином, сумарна форма рівняння хімічної реакції не відображає складності й багатостадійності процесу, який може складатися з декількох елементарних реакцій різного порядку. Вплив температури на швидкість реакцій. Енергія активації Як уже зазначалося, умовою елементарного акту взаємодії є зіткнення реагуючих часток. Однак не кожне зіткнення може обумовлювати хімічну взаємодію. Насправді вона передбачає перерозподіл електронної густини, утворення нових хімічних зв’язків і перегрупування атомів. Таким чином, енергія реагуючих часток повинна бути більша за енергію відштовхування (енергетичний бар’єр) між їх електронними оболонками. Унаслідок перерозподілу енергії частина молекул у системі завжди має певний її надлишок порівняно із середньою енергією молекул. Тому вони можуть подолати енергетичний бар’єр і вступити в хімічну взаємодію. Такі реакційноздатні здатні молекули називають активними. Різниця між середньою енергією системи і енергією, необхідною для перебігу реакції, називається енергією активації реакції. Вона потрібна для подолання енергетичного бар’єра. Наявність енергетичного бар’єра є причиною того, що багато реакцій, перебіг яких повністю можливий, самовільно не починаються. Наприклад, вугілля, деревина, нафта, здатні окиснюватися й горіти на повітрі, за звичайних умов не спалахують. Це пов’язано з великою енергією активації відповідних реакцій окиснення. Підвищення температури збільшує кількість активних молекул, тому дедалі більше молекул кисню, вугілля, деревини, нафти набувають необхідного запасу енергії для початку реакції. За певної температури швидкість реакції досягає певної величини, і починається реакція горіння. Щоб почали утворюватись нові хімічні зв'язки, повинні бути ослаблені або розірвані зв'язки між атомами у вихідних молекулах. Для цього потрібно затратити енергію. Так, у реакції водню з йодом: Н2 + І2 = 2НІ під час зіткнення молекул починають подовжуватись зв'язки Н—Н та І—І. Вони послаблюються і тільки тоді утворюються нові зв'язки Н—І. У результаті виникає угруповання, яке називають активованим комплексом або перехідним станом. Після утворення перехідного стану відбувається процес подальшої побудови нових зв'язків і остаточного розриву вихідних. Хімічне перетворення можна подати у вигляді такої схеми (рис. 16):
Вихідні речовини ® Перехідний стан ® Продукти реакції
Рис. 16. Схема взаємодії водню та йоду Зміну енергії реагуючих часток під час хімічного перетворення можна відобразити на енергетичній діаграмі, абсцисою якої є координата реакції, пов'язана з між'ядерними відстанями (рис. 17).
а б Рис. 17. Енергетичні діаграми: а – екзотермічної реакції; б – ендотермічної реакції
Таким чином, під час хімічного процесу зміна енергетичного стану Е вих. вихідних речовин на енергетичний стан Е пр. здійснюється через енергетичний бар’єр, який дорівнює енергії активації системи Е 0. При цьому тепловий ефект реакції D Н = Е пр. – Е вих.. Під час ендотермічної реакції енергія продуктів реакції більша, ніж енергія вихідних речовин (рис. 17, б), для екзотермічної - навпаки, енергія продуктів менша за енергію вихідних речовин (рис. 17, а). Однак в обох випадках між вихідними речовинами і продуктами реакції утворюється активований комплекс, що має підвищену енергію. Різницю енергій перехідного стану та вихідних речовин називають енергією активації або потенціальним бар'єром реакції. Отже, у процесі хімічного перетворення можуть бути задіяні не всі молекули, а тільки так звані активні, тобто ті, що мають енергію, достатню для утворення перехідного стану. Енергія активації D Е акт. – важлива характеристика хімічних перетворень. Саме вона затримує чи робить неможливими багато реакцій, які з позиції термодинаміки можуть відбуватися самочинно. Таким чином, існування більшості молекул, кристалічних речовин і навіть живих клітин можливе тому, що процеси їх перетворення і руйнування пов’язані з подоланням значного енергетичного бар’єра. Підвищення температури реагуючих часток унаслідок зростання швидкості молекул зумовлює збільшення загальної енергії системи і відповідно відносного вмісту активних молекул, що рівноцінно зростанню швидкості хімічної реакції. Вплив температури й енергії активації на швидкість хімічних реакцій можна виразити за допомогою залежності константи швидкості реакції k від температури Т і енергії активації, яка має назву рівняння Арреніуса:
або у логарифмічній формі де А – множник Арреніуса, чи частотний фактор, пропорційний числу зіткнень молекул. Якщо концентрації реагуючих речовин дорівнюють 1 моль/л, то рівняння Арреніуса дає можливість виразити залежність швидкості реакції від температури: v Оскільки в рівнянні температура входить у показник степеня, то швидкість хімічних реакцій значною мірою залежить від зміни температури. Експериментально встановлено, що залежність швидкості хімічної реакції від температури можна виразити у вигляді емпіричного правила Вант-Гоффа: із підвищенням температури на кожні 10 градусів швидкість реакції зростає в 2 -4 рази. У математичній формі правило Вант-Гоффа записується так:
де D t – різниця (зростання) температур; v1 – швидкість реакції до підвищення температури; v2 – швидкість реакції після підвищення температури (при температурі t 2); g - температурний коефіцієнт швидкості реакції (g=2…4). Температурний коефіцієнт вказує, у скільки разів зросте швидкість реакції, якщо температура підвищиться на 10 градусів. Каталіз Каталізатор — це речовина, якабере участь у проміжних стадіях реакції, прискорює її, але не входить до складу продуктів реакції і по її закінченні залишається незмінною. Каталізатори мають величезне значення під час промислових і лабораторних хімічних процесів, а також хімічних реакцій, що відбуваються в живих організмах, атмосфері, гідросфері. Так, у листках рослин під дією особливих каталізаторів - ферментів - вуглекислий газ, вода й поглинуте сонячне світло синтезують різноманітні складні органічні сполуки. В організмі людини за участю ферментів відбуваються складні процеси перетворення хімічних сполук, що забезпечують його життєдіяльність. Ферменти відіграють важливу роль у харчовій промисловості, в окремих випадках здійснюють чи допомагають здійснювати багато технологічних процесів, а в інших – ускладнюють їх проведення. Зокрема, перетворення вихідної сировини в таких галузях харчової промисловості, як виробництво вина, пива, спирту, хліба, ряду кисломолочних продуктів, здійснюється за безпосередньої участі ферментів.
За наявності каталізатора виникають інші активовані комплекси, для утворення яких потрібна менша енергія, ніж для утворення активованих комплексів без каталізатора. Наприклад, якщо деякій реакції А + В = АВ (E a)
ним нестійку сполуку: А + К = А...К (Е 'а), яка далі реагує з речовиною В з виділенням каталізатора Кі утворенням кінцевого продукту: А...К + В = АВ + К (Е а). Енергія активації проміжних стадій (Е' ата Е' а ) менша за енергію активації реакції, яка відбувається без каталізатора, тому більша частка молекул матиме достатню енергію для утворення активованих комплексів, що виникають за наявності каталізатора. Розрізняють два види каталізу — гомогенний і гетерогенний. Під час гомогенного каталізу каталізатор і речовини, які беруть участь у реакції, утворюють одну фазу (газ або розчин). Під час гетерогенного каталізу каталізатор перебуває в системі у вигляді самостійної фази. Реакція 2Н2О2 = 2Н2О + О2, яка відбувається у водному розчині, прискорюється в разі додавання іонів ОН- (розчину лугу), вільного Вr2 або твердого МnО2, тобто для однієї тієї самої реакції можливий і гомогенний, і гетерогенний каталіз. Хімічна рівновага Вивчаючи основні закономірності рівноважних процесів, перш за все необхідно розглянути поняття оборотних і необоротних реакцій, оборотність хімічних процесів. Необоротними хімічними реакціями називаються реакції, які відбуваються тільки в одному напрямку. До таких належать, наприклад, реакції розкладу калій перманґанату під час нагрівання: 2KMnO4 = K2MnO4 + MnO2 + O2 чи взаємодія лужних металів з водою: 2K + 2H2O = 2KOH + H2. Оборотними називаються реакції, які можуть відбуватися в прямому та зворотному напрямках. До таких реакцій належить, наприклд, взаємодія кисню з воднем: 2H2 + O2 Û 2H2O. За температури 800 – 1500°С кисень із воднем утворюють воду, взаємодіючи дуже бурхливо. При температурі 3000 – 4000°С навпаки, вода розкладається з утворенням Н2 і О2. Взаємодія йоду з воднем H2 + I2 Û 2HI відбувається при температурі 300 – 400°С. За такої ж температури можлива й зворотна реакція розкладу гідроген йодиду. Більшість хімічних реакцій оборотні. Але для одних за певних умов зворотний напрямок неможливий (взаємодія Н2 і О2), а для інших можливі як прямий, так і зворотний (взаємодія Н2 і I2). В обох наведених прикладах можна виявити зворотну реакцію і навіть визначити швидкість обох напрямків. Існують умови, за яких одночасно відбуваються пряма і зворотна реакції. Однак відомі процеси, для яких визначити швидкість зворотної реакції неможливо і тому можна тільки говорити про її оборотність. З’ясуємо, якою мірою той чи інший оборотний процес залежить від природи реагуючих речовин і умов, за яких здійснюється. Розглянемо більш детально оборотні реакції, які одночасно за певних умовах відбуваються у двох напрямках: aA + bB Û cC + dD. У перший момент швидкість прямої реакції
визначається початковими концентраціями вихідних речовин. Швидкість зворотної реакції при цьому дорівнює нулю. У міру взаємодії А і В і утворення С і D швидкість прямої реакції зменшується, а зворотної -
зростає. Через певний час швидкості прямої і зворотної реакцій зрівняються (рис. 19). При цьому кількість утворених молекул С і D буде дорівнювати кількості молекул С i D, які прореагували й перетворились на А і B. Стан реагуючої системи, за якого швидкості прямої та зворотної реакцій однакові, називається хімічною рівновагою. У стані хімічної рівноваги кількість і концентрація вихідних речовин, а також продуктів їх реакції не змінюються (рівноважні), тобто хімічна рівновага має динамічний характер. Момент хімічної рівноваги, коли швидкості прямої і зворотної реакції однакові, можна записати так:
звідки
За даної температури константи швидкостей k 1 і k 2 є сталими величинами, тому їх відношення
Це рівняння є математичним виразом закону діючих мас для стану рівноваги. Константа рівноваги залежить від температури, зміни ентальпії та ентропії, але не залежить від енергії активації, яка впливає лише на час встановлення рівноваги. Тому каталізатор, знижуючи енергію активації й підвищуючи ентропію активації прямої та зворотної реакцій, прискорює встановлення рівноваги, не змінюючи її константу. Змінюючи умови, можна перевести систему з одного рівноважного стану в інший, що відповідає новим умовам. Рівновага зміщується тому, що зміна умов неоднаково впливає на швидкість прямої та зворотної реакцій. Характер зміщення рівноваги залежно від зовнішніх факторів можна визначити за принципом Ле Шательє(1884): якщо на систему, що перебуває в стані рівноваги, впливати ззовні, то рівновага зміщується в бік тієї реакції, яка послаблює цей вплив. Згідно з принципом Ле Шательє: 1) нагрівання сприяє перебігу ендотермічної, а охолодження - екзотермічної реакцій; 2) підвищення тиску зумовлює зміщення рівноваги в бік утворення тих речовин, які займають менший об'єм, а зниження тиску - у протилежний бік. Якщо об'єм системи під час реакції не змінюється, то тиск не впливає на стан рівноваги; 3) введення в систему додаткової кількості будь-якого з реагентів викликає зміщення рівноваги в тому напрямку, в якому його концентрація зменшується. У зв’язку з цим введення в систему вихідних речовин зміщує рівновагу в бік утворення продуктів реакції, а збільшення концентрації продуктів реакції - у бік утворення вихідних речовин; 4) однаково прискорюючи як пряму, так і зворотну реакції, каталізатор сприяє швидкому встановленню рівноваги, не впливаючи на рівноважні концентрації речовин. Принцип Ле Шательє дає змогу передбачити напрямок реакції за різних умов і, отже, керувати їх перебігом. Він справджується не тільки для хімічних процесів, а має загальнонаукове значення і поширюється на всі процеси, які перебувають у стані динамічної рівноваги. На практиці принцип Ле Шателье особливо важливий у харчовій промисловості. Визначаючи положення рівноваги для різних температур і тиску, можна вибрати найсприятливіші умови проведення технологічного процесу: необхідно, щоб досягався максимально можливий вихід продукту (зміщення хімічної рівноваги) за найбільшої швидкості його утворення. ПІДСУМКИ Необхідно зрозуміти 1. Для характеристики хімічної реакції необхідно знати основні закономірності її перебігу за певний час, мати дані про швидкість і механізм процесу. 2. Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора та деяких інших зовнішніх факторів. 3. Енергія активації – важлива характеристика хімічних перетворень. Саме вона затримує чи робить неможливими багато реакцій, які з позиції термодинаміки можуть відбуватися самочинно. 4. Хімічна рівновага зміщується тому, що зміна умов неоднаково впливає на швидкість прямої та зворотної реакцій. Треба вміти 1. Обчислювати швидкість хімічної реакції за законом діючих мас. 2. Визначати залежність швидкості хімічної реакції від температури, застосовуючи емпіричне правило Вант-Гоффа. 3. Визначати характер зміщення хімічної рівноваги під дією зміни зовнішніх факторів. Слід запам’ятати 1.Закон діючих мас. 2.Правило Вант-Гоффа. 3.Принцип Ле Шательє.
|
||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 520; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.23.138 (0.015 с.) |



 ,
, ,
, .
. ,
, Швидкість реакції істотно залежить від енергії активації, причому зменшення останньої (потенціального бар'єра) забезпечує зростання швидкості. Здебільшого дію каталізаторів пояснюють тим, що вони знижують енергію активації. Схема, що відображає різницю енергій активації стадій каталітичного процесу і процесу, який відбувається без каталізатора, наведена далі (рис. 18).
Швидкість реакції істотно залежить від енергії активації, причому зменшення останньої (потенціального бар'єра) забезпечує зростання швидкості. Здебільшого дію каталізаторів пояснюють тим, що вони знижують енергію активації. Схема, що відображає різницю енергій активації стадій каталітичного процесу і процесу, який відбувається без каталізатора, наведена далі (рис. 18).
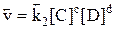
 v1 = v2, або
v1 = v2, або ,
,
 - також стала величина.
- також стала величина.



