
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дисоціація води. Іонний добуток води. Водневий показникСодержание книги
Поиск на нашем сайте
Чиста вода є слабким електролітом, який незначною мірою проводить електричний струм. При 22°С її ступінь електричної дисоціації дорівнює
Для спрощення і зручності рівняння записують в такому вигляді:
Застосувавши до цієї рівноваги закон діючих мас, маємо:
де К – константа електричної дисоціації води, вона дорівнює 1,8∙10-16. Оскільки ступінь дисоціації води дуже маленька величина, то практично [H2O]=const (кількість дисоційованих молекул не враховується) і тоді
Константа Оскільки Таким чином, Значення В умовах кімнатної температури нейтральні розчини мають однакову концентрацію:
Наприклад, концентрація іонів Гідрогену в 5×10-3 М розчину натрій гідроксиду дорівнює
Однак записувати концентрацію іонів [H+] та [OH−], застосовуючи від’ємний степінь не зовсім зручно. Тому кислотні властивості розчинів датський біохімік Серенса запропонував характеризувати величиною водневого показника р Н, який визначається співвідношенням
або оскільки експериментально в розчині визначають не концентрацію іонів гідрогену, а їх активність (a=f C). Рівняння (31) можна записати в такому вигляді:
де Оскільки концентрація іонів Гідрогену може змінюватися в межах іонного добутку, то р Н змінюється в інтервалі від 0 до 14. У нейтральному розчині
Таким чином, кислий розчин нейтральний розчин лужний розчин Розчини, значення р Н яких знаходяться в інтервалі від 0 до 3, належать до сильнокислих; при р Н = 4…6 – до слабкокислих. Слабколужні розчини мають р Н = 8…10, а сильнолужні – р Н = 11…14. Розчини, в яких При ПІДСУМКИ Необхідно зрозуміти 1. Іонні реакції можна вважати такими, що відбулися, лише в тих випадках, коли утворюються: а) нерозчинні речовини, які випадають в осад; б) газоподібні речовини; в) малодисоційовані речовини. 2.У розчинах слабких електролітів електростатичні сили взаємодії між іонами можна не враховувати, оскільки 3. У насиченому за певної температури розчині добуток концентрацій іонів малорозчинного електроліту являє собою сталу величину, яка називається добутком розчинності й позначається ДР. Введення однойменних іонів (до 50% надлишку) в розчин малорозчинного електроліту зменшує його розчинність. 4. Кислотні властивості розчинів характеризують величиною рН середовища, який називають водневим показником. Треба вміти 1. Писати рівняння іонних реакцій у розчинах електролітів: повне молекулярне, повне іонне та скорочене іонне. 2. Здійснювати розрахунок р Н середовища в розчинах, утворених слабкими та сильними електролітами. 3. Із застосуванням констант (К д, ДР, S) розраховувати рівновагу в розчинах електролітів; створювати умови для випадіння осадів та запобігати цьому процесу. Слід запам’ятати 1.Прості речовини, оксиди, а також нерозчинні речовини не дисоціюють. 2. Якщо малорозчинна речовина утворюється в результаті реакції, то в записі іонного рівняння її вважають нерозчинною. 3. Формули розрахунку: ступеня дисоціації електроліту −
іонної сили розчину −
активності − a=f C; добутку розчинності −
іонного добутку води −
р Н середовища −
або
Гідроліз Реакції обмінної взаємодії в розчинах дуже поширені й відбуваються не тільки між електролітами, а й між розчиненою речовиною та розчинником. Останні називаються реакціями гідролізу. Гідроліз – це обмінна взаємодія речовин із водою, під час якої складові частини речовини сполучаються зі складовими частинами води. Найяскравішим прикладом такого типу обмінної взаємодії є гідроліз солей. Вимірювання рН водних розчинів солейпоказали, що часто значення водневого показника бувають більшими (лужне середовище) або меншими (кисле середовище) ніж 7. Причиною цього є взаємодія солі з водою, або процес гідролізу. Сутність процесу гідролізу солей полягає в тому, що іони солі зв’язують складові частини води (Н+, ОН− або обидва ці іони) з утворенням малодисоційованого електроліту. Унаслідок цього рівновага процесу електролітичної дисоціації води Н2О ↔ Н+ + ОН− певною мірою зміщується вправо. Наприклад, перебіг реакції обмінної взаємодії солі МеА з водою, яка супроводжується зв’язуванням іонів ОН− води з катіонами металу Меn+ у слабкий електроліт, можна пояснити такою схемою:
Загальне рівняння гідролізу таких солей матиме вигляд
Для іншої групи солей перебіг процесу гідролізу забезпечується зв’язуванням іонів H+ води аніонами солі з утворенням слабкої кислоти:
У цьому разі гідроліз солі можна описати таким іонним рівнянням:
Обмінна взаємодія солі з водою посилюється в разі одночасного зв’язування іонів Н+ та ОН− води зі складовими частинами солі:
Загальне рівняння гідролізу має вигляд
Природно, що коли іони Н+ та ОН− води не зв’язуються, гідроліз солей не відбувається і рівновага процесу дисоціації води не зміщується. Отже, гідроліз солей має місце лише тоді, коли іони води зв’язуються з іонами солі, утворюючи слабкі кислоти або слабкі основи. Звідси випливає, що гідролізу піддаються солі, утворені слабкими кислотами, слабкими основами або одночасно слабкими кислотами й основами. Солі сильних кислот та основ гідролізу не піддаються. Гідроліз солей – це процес, зворотний до реакцій нейтралізації слабких кислот або слабких основ, які не відбуваються до кінця у зв’язку з перебігом зворотної реакції – гідролізу утвореної солі:
Ступінь та константа гідролізу. Кількісними характеристиками гідролізу є його ступінь та константа. Ступінь гідролізу солі (h) − це відношення концентрації солі, що піддалася гідролізу, до її загальної концентрації. Аналогічно до ступеня дисоціації ступінь гідролізу може змінюватися від 0 до 1, або від 0 до 100 %. Оскільки гідроліз є зворотним процесом, для його характеристики можна застосувати закон діючих мас та розрахувати константу рівноваги – константу гідролізу (К г). Розглянемо рівняння гідролізу солі, утвореної слабкою кислотою та сильною основою:
У розведених розчинах концентрація води є константою, тому рівняння гідролізу набуває такого вигляду:
Помноживши чисельник та знаменник на концентрацію іонів Гідрогену [H+], одержимо:
Таким чином, константа гідролізу солі, утвореної сильною основою та слабкою кислотою, дорівнюватиме частці іонного добутку води на константу дисоціації кислоти. Чим слабша кислота (менше значення константи дисоціації), тим сильніше вона піддається гідролізу. За аналогією можна довести, що константа гідролізу солі, утвореної слабкою основою та сильною кислотою, дорівнює
А для солі, утвореної слабкими основою та кислотою
Щоб визначити зв'язок між К г та h, наприклад, для солі сильної основи та слабкої кислоти, треба записати іонне рівняння її гідролізу:
Якщо позначити вихідну концентрацію солі в розчині через С (моль/л), а ступінь гідролізу h,то
Рівняння для розрахунку константи гідролізу можна записати так:
При h <<1 рівняння спрощується:
Оскільки
Із останнього рівняння випливають такі важливі висновки: 1) ступінь гідролізу буде тим більшим, чим менша концентрація розчину солі; 2) гідроліз солі підсилюється із підвищенням температури розчину, оскільки при цьому збільшується концентрація іонів Гідрогену та гідроксилу (із підвищенням температури константа води зростає); 3) чим слабша кислота, аніон якої утворює сіль (тобто чим менша константа дисоціації кислоти), тим більш повним є гідроліз солі. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Реакції, під час яких змінюються ступені окиснення елементів, що входять до складу реагуючих речовин, називаються окисно-відновними. Процес віддачі електронів – це окиснення, приєднання електронів – відновлення. Елементи, а отже, й речовини, які віддають електрони – відновники, а які їх приєднують – окисники. Розрізняють такі типи окисно-відновних реакцій: міжмолекулярні, внутрішньомолекулярні та реакції диспропорціювання (самоокиснення-самовідновлення). ПРАКТИЧНІ ЗАНЯТТЯ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 588; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.91.15 (0.011 с.) |

 , тобто дисоціює тільки одна з 555∙106 молекул води. Однією із причин цього є те, що дисоціація пригнічується дією водневих зв’язків, типових для води. Дисоціацію води можна записати так:
, тобто дисоціює тільки одна з 555∙106 молекул води. Однією із причин цього є те, що дисоціація пригнічується дією водневих зв’язків, типових для води. Дисоціацію води можна записати так: .
. .
. , або
, або 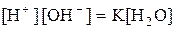 ,
, .
. називається іонним добутком води.
називається іонним добутком води. , то при 220С
, то при 220С 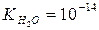 .
. .
. є постійною величиною за даної температури.
є постійною величиною за даної температури. та
та  . Таке саме значення мають при тій же самій температурі й розведені водні розчини кислот і основ. Тому, якою б не була концентрація іонів Гідрогену, концентрація гідроксид-іонів не буде мати нульового значення або навпаки. Це дає можливість розраховувати концентрацію [H+] або[OH−], якщо одна з цих величин відома:
. Таке саме значення мають при тій же самій температурі й розведені водні розчини кислот і основ. Тому, якою б не була концентрація іонів Гідрогену, концентрація гідроксид-іонів не буде мати нульового значення або навпаки. Це дає можливість розраховувати концентрацію [H+] або[OH−], якщо одна з цих величин відома: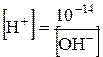 та
та  .
. .
. ,
,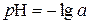 , (31)
, (31) ,
, − коефіцієнт активності іонів Гідрогену, значення якого в розведених розчинах наближається до одиниці. Тоді
− коефіцієнт активності іонів Гідрогену, значення якого в розведених розчинах наближається до одиниці. Тоді  .
.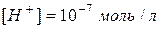 ;
; 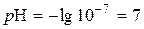 .
. ;
;  . Так, для
. Так, для  М розчину
М розчину 
 ;
;  . Для розчину
. Для розчину 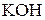 тієї ж концентрації
тієї ж концентрації ;
;  .
. ;
;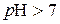 .
.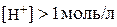 , мають від’ємне значення р Н. Так, якщо
, мають від’ємне значення р Н. Так, якщо  , то
, то  .
.
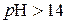 . Якщо
. Якщо  , то
, то  . Вивчення р Н розчинів має велике практичне значення в хімії, біології, медицині, харчовій промисловості, сільському господарстві та ін.
. Вивчення р Н розчинів має велике практичне значення в хімії, біології, медицині, харчовій промисловості, сільському господарстві та ін. . У розчинах сильних електролітів сили електростатичної міжіонної взаємодії в розчині враховуються, для чого й застосовують значення іонної сили розчину та коефіцієнтів активності.
. У розчинах сильних електролітів сили електростатичної міжіонної взаємодії в розчині враховуються, для чого й застосовують значення іонної сили розчину та коефіцієнтів активності. ;
; ;
; ;
; ,
,

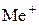






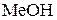
 Зміщення рівноваги процесу дисоціації води
Зміщення рівноваги процесу дисоціації води
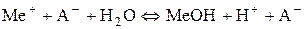 .
. .
.
 .
.
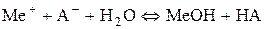 .
. Реакція гідролізу
Реакція гідролізу
 .
. .
. .
. .
.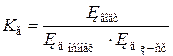 .
. .
. ;
; ;
; .
.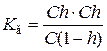 , або
, або 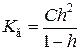 .
. та
та  .
. , то
, то 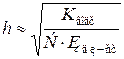 .
.


