Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічна кінетикА та рівновагаСодержание книги
Поиск на нашем сайте
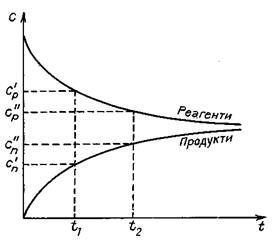
Свіжовідрізана скибочка яблука досить швидко на повітрі стає коричневою, а бронзовий пам’ятник на вологому повітрі повільно вкривається нальотом зеленого кольору – основним карбонатом купруму. Золоті прикраси зберігають на повітрі свій блиск століттями. Петарда, кинута в полум’я, миттєво вибухає. Цікаво, що з позиції термодинаміки можливі всі названі процеси, навіть окиснення золота. Просто відбуваються вони з різною швидкістю. Для правильного розуміння перебігу хімічної реакції крім енергетичних характеристик (D Н, D S) необхідно також знати основні закономірності її перебігу за певний час, тобто мати дані про швидкість і механізм процесу. Предмет хімічної кінетики Розділ хімії, який вивчає перебіг хімічних процесів за певний час, називається хімічною кінетикою. Дослідження кінетики хімічних процесів має не тільки теоретичний, а й практичний інтерес. У необхідності врахування кінетичного фактора під час розгляду хімічних реакцій можна переконатись на прикладі взаємодії кисню і водню. Не звертаючи увагу на те, що реакція 2Н2(г) + О2(г) = 2Н2О(г), DG = -456,4 кДж характеризується значним зменшенням енергії Гіббса, тобто є можливість самочинного перебігу процесу, за звичайних умов водень і кисень між собою не реагують, а їх суміш може зберігатися будь-який час. За наявності каталізатора чи в разі нагрівання до» 700°С (DG°1000 = -495,3 кДж) суміш реагує дуже швидко, а іноді навіть із вибухом. В обох випадках енергія Гіббса системи майже однакова, а кінетичні особливості різні. Таким чином, від’ємне значення зміни енергії Гіббса є необхідною, але не достатньою умовою перебігу процесів. Існує багато галузей технології, виробництва й науки, у яких швидкості реакцій належить провідна роль. Дуже важливо знати, з якою швидкістю згоряє паливо в автомобільному двигуні, як швидко твердне бетон або нанесений на підлогу лак, від чого залежить швидкість корозії металу. Для процесів, що відбуваються під час виготовлення харчових продуктів теж важливими є знання про швидкість їх перебігу та умови інтенсифікації. Вивчення чинників, які впливають на швидкість процесів, визначення оптимальних умов, за яких можна здійснити реакцію добування заданої речовини, є предметом хімічної кінетики. Перш ніж розглядати питання про швидкість реакції, зазначимо, що хімічні реакції можуть відбуватися в гомогенній (однорідній) і в гетерогенній (неоднорідній) системах. Гомогенна система складається з однієї фази, гетерогенна − з кількох. Фазою називають однорідну частину системи, однакову за складом та властивостями і відокремлену від інших фаз поверхнею поділу. Гомогенні реакції відбуваються в усьому об’ємі системи, гетерогенні – на поверхні поділу фаз. Прикладами гомогенних реакцій є взаємодія в газових сумішах, розчинах, гетерогенних – взаємодія металів із киснем, розчинами кислот, солей тощо. Швидкість хімічних реакцій Хімічні перетворення відбуваються в разі зіткнення молекул, якщо в результаті цього перебудовуються хімічні зв’язки, тобто зв’язки у вихідних молекулах розриваються, а нові - утворюються. Швидкість хімічної реакції характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії чи розкладу за одиницю часу в одиниці об’єму (для гомогенних реакцій) чи на одиницю поверхні поділу фаз (для гетерогенних). Для гомогенних процесів, які відбуваються без зміни об’єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин чи продуктів реакції за одиницю часу. Зміна концентрацій дорівнює різниці між концентрацією С 2, яка відповідає моменту часу t2, і вихідною (початковою) концентрацією С 1 у момент часу t1. Тоді середня швидкість реакції дорівнює v Концентрація речовин у процесі реакції весь час змінюється, а це впливає на її швидкість, тому слід розглядати миттєву швидкість реакції, тобто швидкість у даний момент часу. Для гомогенних реакцій – це похідна концентрації за часом:
кривої залежності концентрації від часу: v = tg a. Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрації, температури, наявності каталізатора та деяких інших зовнішніх факторів.
|
||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 137; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.50.170 (0.005 с.) |


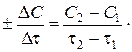
 v
v