
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 1. Визначення реакції розчинів за допомогою індикаторів.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
КИЇВ КДАВТ 2003
Методичні вказівки до лабораторних робіт з курсу «Хімія для студентів спеціальностей «Судноводіння на морських і внутрішніх водних шляхах» та «Експлуатація суднових енергетичних установок».
Укл. Т.О.Сєрова ст. викладач.
1.1 Методичні вказівки до вивчення теоретичного матеріалу До основних класів неорганічних сполук належать оксиди, кислоти, основи, солі. Оксидами називають сполуки елементів з киснем, ступінь окислення якого –2. Так, Са2+О2- - кальцій оксид, а Са2+О2 – кальцій пероксид (містить пероксидну групу –0 –0 -). За хімічним характером оксиди поділяють на солетворні і несолетворні (NO, CO. SiO та ін.). Солетворні оксиди, в свою чергу, поділяють на основні, кислотні, амфотерні. Основними називають оксиди, гідратами яких є основи. Це оксиди металів у нижчих ступенях окислення. Серед них тільки оксиди лужних і лужноземельних металів реагують з водою, утворюючи розчинні у воді основи – луги:
Li2O+H2O=2LiOH
Кислотними називають оксиди, гідратами яких є кислоти. Їх також називають ангідридами відповідних кислот. Це оксиди неметалів (SO2, N2O3, SO3…) і деякі оксиди металів у вищих ступенях окислення (Mn2O7, V2O5, CrO3…). Кислотні оксиди взаємодіють з водою з утворенням кислот (виняток SiO2).
SO2+H2O=H2SO3
Амфотерними називають оксиди, які залежно від умов виявляють властивості основних і кислотних оксидів. Наприклад, BeO, ZnO, Al2O3, Cr2O3, Fe2O3, MnO2 та ін. З водою не взаємодіють. Методи добування то основні властивості оксидів детально описані в наведених підручниках. Слід звернути увагу на зв’язок між властивостями хімічних елементів, ступенем їх окислення і хімічним характером оксидів та гідроксидів, що утворюються. Так, хром (ІІ) оксид CrO – основний, хром (ІІІ) оксид Cr2O3 – амфотерний, а хром (VI) оксид CrO3 – кислотний. Їм відповідають хром гідроксид Cr(OH)2 , амфотерний хром гідроксид Cr(OH)3 і хромова кислота H2CrO4. Тобто хімічний характер оксидів із зростанням ступеня окислення змінюється від основного через амфотерний до кислотного. Таким же чином і в межах малих періодів і рядів великих періодів із збільшенням порядкового номера елементів змінюється характер вищих оксидів від основних через амфотерні до кислотних.
При вивченні номенклатури необхідно запам’ятати технічні назви деяких оксидів і гідроксидів, які використовуються в будівництві. Наприклад, СаО – гашене вапно, MgO – палена магнезія, Al2O3 – глинозем, SiO2 – кварц, пісок та ін. Найскладнішим у вивченні цієї теми є розуміння поняття “амфотерність”. Амфотерність – це властивість оксидів і гідроксидів залежно від умов перебігу процесу реагувати як з кислотами, так і з основами. З кислотами амфотерні оксиди реагують як основні оксиди, а амфотерні гідроксиди – як слабкі основи з утворенням солей відповідних кислот:
Al2O3+6HCl=2AlCl3+3H2O
Характер продуктів реакції амфотерних оксидів і гідроксидів з гідроксидами і карбонатами активних металів залежить від умов. У водних розчинах реакції відбуваються з утворенням комплексних гідроксосолей:
Al2O3+3H2O+2NaOH=2Na[Al (OH4)]
Al(OH)3+ NaOH(P-H)_ натрій гексогідроксоалюмінат
Al (OH)3+ 3NaOH натрій метаалюмінат
При високій температурі утворюються безводні солі: to
to
При вивченні основ необхідно звернути увагу на їх кислотність. Це поняття використовують у багатьох хімічних розрахунках. Кислотність дорівнює кількості гідроксогруп ОН-, які зв’язані із катіоном металу в основі, або заміщені в хімічній реакції. Так, NH4OH – амоній гідроксид – це однокислотна основа. Запам’ятайте, що одно - і багатокислотні основи можуть утворювати один, або кілька основних залишків. Основний залишок – це група атомів, яка утворюється внаслідок ступінчатого відриву від основи гідроксогруп ОН-.
NaOH Al (OH)3 Al (OH)+2 Al (OH) 2+ Al (OH)3
Зверніть увагу на позитивний заряд основних залишків. 1.2 Проведення дослідів
ЛАБОРАТОРНА РОБОТА №2
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Кислотами називають складні речовини загальної формули HXEYOZ (E – елемент). Кислоти, молекули яких не містять атомів кисню, називають безкисневими, наприклад, HCl – хлоридна (хлорводнева), H2S – сульфідна (сірководнева) та ін. Однією з основних характеристик кислот є їх основність. Основність кислоти – це кількість атомів водню в кислоті, здатних заміщуватись у хімічних реакціях. Негативні іони, що залишаються в молекулі кислоти після відщеплення одного або кількох іонів водню називаються кислотними залишками. Основні кислоти утворюють один кислотний залишок, а дво- чи триосновні – два чи три кислотні залишки. Наприклад, ацетатна (оцтова) кислота є одноосновною, оскільки у водних розчинах в її молекулі може заміщуватись лише один Н+-іон. При цьому утвориться один кислотний залишок.
О-Н ацетат-іон
Для багатоосновних кислот процес заміщення Н+-іонів відбувається ступінчасто:
-Н+ -Н+ -Н+
утворюються утворюються кислі солі середні солі
Кислоти та їх залишки
Найхарактернішою ознакою кислот є їх здатність утворювати солі при взаємодії з основами (реакція нейтралізації), основними оксидами і металами. Солі – це сполуки, до складу яких входять катіони металів та аніони кислотних залишків. Солі бувають середні, кислі і основні. Середні солі можна розглядати як продукти повного заміщення водню кислоти металом, наприклад, Al2(SO4)3, MgCl2. Кислі солі – продукти неповного заміщення водню багатоосновної основи на кислотні залишки, наприклад, Mg(НSO4)2, Ca(HSO4)2. Основні солі – продукти неповного обміну гідроксогруп (ОН-) багатокислотної основи на кислотні залишки, наприклад, CuOHCl, Al(OH)2Cl. Існує багато методів добування солей, які детально описані в літературі. Зверніть увагу на те, що за реакцією нейтралізації можна добути (залежно від молярних співвідношень реагентів) як середні, так і кислі та основні солі.
2Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O алюміній сульфат 2Al(OH)3 + 3 H2SO4 = Al2(НSO4)3 + 3 H2O алюміній гідросульфат 2Al(OH)3 + H2SO4 = [ Al(OH)2]2 SO4 + 2 H2O алюміній дигідроксосульфат Al(OH)3 + H2SO4 = Al(ОН)SO4 + 2 H2O алюміній гідроксосульфат Для перетворення кислих і основних солей в середні треба подіяти на них відповідно основою або кислотою. Назви солей складаються з назви хімічного елементу і назви кислотного залишку в називному відмінку і залишку в родовому відмінку. Багато солей мають також технічну назву.
1.2 Проведення дослідів
ЛАБОРАТОРНА РОБОТА №3
1.1 Методичні вказівки до вивчення теоретичного матеріалу Розділ хімії, що займається визначенням швидкостей хімічних реакцій та механізмів їх перебігу, називається хімічною кінетикою. Швидкість хімічної реакції пов’язана із зміною кількості речовини за одиницю часу. При цьому потрібно розрізняти швидкість гомогенної і гетерогенної реакцій, а також запам’ятати, що розмірність швидкості хімічної реакції – моль/(л.с). Принципова можливість довільного протікання реакцій визначається обов’язковою, але не завжди достатньою термодинамічною умовою ∆GP,T<0 або ∆SP,T>0. Швидкість хімічних процесів залежить від багатьох факторів, до яких належить природа речовин, концентрація (для газів – тиск) реагентів, температура та дія каталізаторів. Залежність швидкості процесу від температури описується рівнянням lgк = - EАКТ/Т + const Тобто чим більша EАКТ, тим меньша швидкість реакції й тим більшою мірою змінюється швидкість залежно від температури. Іноді користуються простим наближеним правилом Вант-Гоффа:
де γ – температурний коефіцієнт реакції, який показує, у скількі разів збільшується швидкість реакції з підвищенням температури на кожні 10 0С. У подальшому необхідно вивчити поняття “каталіз”, “каталізатори”, “механізм дії каталізаторів”, з’ясувати різницю між гомогенним та гетерогенним каталізом. Важливо мати уявлення про інгібітори – сповільнювачі швидкості хімічної реакції.
1.2 Проведення дослідів ЛАБОРАТОРНА РОБОТА №4
1.1 Методичні вказівки до вивчення теоретичного матеріалу Для закріплення знань про швидкість хімічної реакції та фактори, що впливають на неї, необхідно розглянути причини, які зумовлюють перебіг реакції в прямому і зворотньому напрямках (оборотність хімічної реакції), а також умови, при яких настає хімічна рівновага. Термодинамічною умовою хімічної рівноваги є рівняння ∆GP,T=0, тобто коли швидкості прямої та зворотньої реакції однакові. Залежність між концентраціями речовин, які знаходяться в стані рівноваги, наприклад, для реакції в загальному вигляді
вихідні речовини продукти реакції
визначається за законом дії мас за формулою:
[A]aР•[B]bР [С]cР•[D]dР
тобто хімічна рівновага настає тоді, коли відношення добутку концентрацій продуктів реакцій до добутку концентрацій вихідних речовин дорівнює деякій сталій величині Кхр – константі хімічної рівноваги. Чим більше її значення, тим більший вихід продуктів реакції. Концентрації, які входять у вираз константи рівноваги, називають рівноважними і позначають Зверніть увагу, що у вираз константи рівноваги гетерогенної реакції, як і у вираз закону дії мас, входять лише концентрації рідких і газоподібних речовин. Чому? Важливо також засвоїти, що хімічна рівновага є динамічною і може бути порушена зміною умов перебігу реакції. Перехід системи із одного стану рівноваги в інший називається зміщенням хімічної рівноваги. Необхідно знати і вміти застосовувати закон дії мас та принцип Ле-Шательє.
1.2 Проведення дослідів ЛАБОРАТОРНА РОБОТА № 5
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Під час хімічних реакцій змінюється не тільки хімічний склад речовин, а й одночасно поглинається або виділяється теплова енергія. Реакції, які супроводжуються зменшенням енергії і виділенням теплоти, називаються екзотермічними, а такі, що супроводжуються збільшенням енергії і поглинанням теплоти – ендотермічними. Хімічні рівняння, в яких вказують тепловий ефект, називають термохімічними рівняннями. Зверніть увагу, що тепловий ефект залежить від кількості речовин, які беруть участь у реакції. Тому для порівняння теплових ефектів їх відносять до І моль сполуки, температури 298 К (25оС) і тиску 760 мм рт. ст. Теплові ефекти за таких умов вважаються стандартними. Якщо в реакції виділяється теплота (+Q), то внутрішня енергія системи, а також ентальпія зменшується (-ΔН), і навпаки, при поглинанні теплоти в реакції (-Q) ентальпія системи збільшується (+ΔН). Теплові ефекти хімічних реакцій вимірюються в джоулях (кілоджоулях).
Слід звернути увагу на різницю між поняттями параметри і функції стану системи. Параметри – це фізичні величини, які можливо безпосередньо виміряти, наприклад, тиск, температура, маса. А термодинамічні функції стану, значення яких визначається сукупністю параметрів, безпосередньо виміряти неможливо. Внутрішня енергія і ентальпія є термодинамічними функціями стану системи, оскільки їх зміна не залежить від проходження процесу, а залежить тільки від початкового і кінцевого стану системи. На цьому базується основний закон термохімії – закон Гесса: тепловий ефект реакції залежить тільки від виду і стану вихідних реагентів і кінцевих продуктів реакції, а не залежить від шляху перебігу реакції. При проведенні реакцій у широких температурних інтервалах необхідно враховувати залежність теплового ефекту від температури, що пов’язано з теплоємністю речовин. Розчинення речовин завжди супроводжується тепловим ефектом. Тепловий ефект розчинення твердих речовин, в основному, визначається алгебраїчною сумою двох складових: теплоти, витраченою на руйнування кристалічної решітки (ΔНреш), і теплоти, що виділяється при взаємодії частинок розчиненої речовини з розчинником (ΔНгідр), тобто теплоти гідратації.
ΔНрозч= ΔНреш+ ΔНгідр
Залежно від співвідношення цих двох складових тепловий ефект може бути позитивним або негативним.
Кожна група студентів окремо виконує запропонований викладачем дослід і розраховує його результат. Потім студенти обмінюються результатами проведених досліджень і роблять загальний висновок про характер реакції та виконання закону Гесса.
1.2 Проведення дослідів ЛАБОРАТОРНА РОБОТА №6
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Вода – слабкий електроліт. Ступінь дисоціації води при 22 0С α Н2О Внаслідок цього утворюється 10-7 моль гідроген-іонів і 10-7 моль гідроксид іонів. Таким чином, концентрація гідроген- і гідроксид-іонів у воді однакові і при температурі 220С дорівнюють [Н+] = [ОН-] = 10-7 моль/л. Добуток концентрацій гідроген- і гідроксид-іонів називають іонним добутком води (I I Іонний добуток води залежить від температури: з її підвищенням він збільшується, із зниженням – зменьшується. Будь-який розчин кислоти, лугу або солі містить гідроген- та гідроксид-іони. Концентрація гідроген-іонів визначає кислотність розчину (середовища), а концентрація гідроксид-іонів – лужність. Розчини, в яких концентрація гідроген- і гідроксид-іонів однакові і дорівнюють 10-7 моль/л, називають нейтральними. Якщо до нейтрального розчину додати кислоту (НА Розчини, в яких концентрація гідроген-іонів перевищує концентрацію гідроксид-іонів [Н+] >[ОН-], називають кислими. Розчини, де концентрація гідроген-іонів меньша, ніж гідроксид іонів [Н+] <[ОН-], є лужними. У кислих і лужних розчинах добуток концентрацій іонів [Н+] [ОН-] – стала величина за сталої температури, [Н+] [ОН-] = 10-14. Тому, знаючи концентрацію одного з цих іонів, можна легко визначити концентрацію іншого. Наприклад, знайдемо концентрацію гідроген- і гідроксид-іонів в 0,01 М розчині HCl. Рівняння дисоціації: HCl [ОН-] = 10-14 /10-2 = 10-12 моль/л Кислотність розчину звичайно виражають через концентрацію гідроген-іонів. Для зручності замість концентрації гідроген-іонів використовують водневий показник рН. Водневий показник рН – це від’ємний десятковий логарифм концентрації гідроген-іонів, рН = - lg [Н+]. Наприклад, при [Н+] = 10-1, рН = 1; при [Н+1] = 10-5, рН = 5 і т.д. Знаючи концентрацію гідроген-іонів, можна визначити рН розчину і навпаки. У нейтральних розчинах [Н+] = [ОН-] = 10-7 моль/л, рН = 7. У кислих розчинах [Н+] >10-7 моль/л, рН < 7. У лужних розчинах [Н+] <10-7 моль/л, рН > 7. Кислотність розчину можна визначити за допомогою індикаторів – речовин, які змінюють свій колір залежно від рН. Зміна кольору індикаторів відбувається в певному інтервалі значень рН. Кожний індикатор характеризується своїм інтервалом переходу (Таблиця 1) Таблиця 1
Існують універсальні індикатори, за допомогою яких можна визначити будь-яке значення рН з точністю до одиниці. Багато промислових, хімічних і біологічних процесів відбуваються лише за певних значень рН розчину.
1.2 Проведення дослідів
ЛАБОРАТОРНА РОБОТА №7
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Більшість хімічних реакцій відбуваються в розчинах при певному оптимальному співвідношенні розчиненої речовини і розчинника. Звернути увагу на приготування розчинів і на розрахунки, що пов’язані з обчисленням концентрації. Розрахункові формули для визначення концентрації розчинів
1.2 Проведення дослідів
ЛАБОРАТОРНА РОБОТА №8
Одним із технологічних показників, який використовують для визначення характеристики якості і складу природних вод є жорсткість води. Жорсткість зумовлена присутністю у воді розчинених кальцієвих та магнієвих солей різних кислот. Здебільшого ці солі представлені у воді катіонами Ca+2, Mg+2 аніонами HCO3 -, SO4 2-, Cl-,CO32-. При вивченні теми слід звернути увагу на класифікацію вод по вмісту солей жорсткості, на причини виникнення жорсткості. Запам'ятати, що згідно ГОСТ 2974-82 допустима жорсткість води для господарсько-питного водопостачання не повинна перевищувати 7 мекв/л. Чому? Розрізняють карбонатну (тимчасову) і некарбонатну (постійну) жорсткість води. Загальна жорсткість - це сума карбонатної та некарбонатної жорсткості води. Карбонатна жорсткість зумовлена присутністю у воді кальцій і магній гідрокарбонатів і може бути частково або повністю усунена нагріванням води до температури вище 60 0С. При цьому відбувається реакція: t
t
Некарбонатну жорсткість воді надають розчинні солі кальцію і магнію та сильних кислот. Ці солі не розкладаються при температурі 60 - 100 градусів, тому пом'якшити таку воду її кип’ятінням неможливо. Усунути або зменшити постійну жорсткість води можна шляхом переводу іонів Ca2+ і Mg2+ в малорозчинні сполуки, якщо додавати до води відповідні хімічні реагенти: Ca(OH)2 , Na2CO3, Na3 PO4 та інші. Запам'ятайте реакції, які відбуваються при цьому:
CaCl2 + Na2 CO3 = CaCO3 ¯ + 2NaCl
3CaCl2 + 2Na3 PO4 = Ca3 (PO4)2 ¯ + 6NaCl
Розберіться, як можна пом'якшити чи знесолити воду методом іонного обміну. Чому цей ефективний метод мало використовується на підприємствах? У методі іонного обміну воду пропускають через іоніти. Це спеціальні тверді речовини, які здатні обмінювати іони, що входять до їх складу на іони, що містяться у воді. Іоніти поділяються на катіоніти (обмінюються катіони) і аніоніти (обмінюються аніони). Для пом'якшення води використовують Na - катіоніти (Na2 R), та H - катіоніти (H2R) i OH - аніоніти (R(OH)2) - для її знесолення. Обмін іонів відбувається в еквівалентних кількостях.
Пом'якшення: CaCl2 + Na2 R = CaR + 2NaCl; MgSO4 + Na2 R = MgR + Na2 SO4; Знесолення: CaCl2 + H2R = CaR + 2 HCl; 2 HCl + R(OH)2= RCl2+ H2O;
Регенерація іонітів здійснюється відповідно розчинами NaCl, HCl i NaOH:
MgR + NaCl = Na2R + MgCl2; CaR + 2HCl = H2R + CaCl2; RCl2 + 2NaOH = R(OH)2 + 2NaCl;
1.2 Проведення дослідів ЛАБОРАТОРНА РОБОТА №9
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Перш за все треба чітко визначитись в поняттях “електроліт”, “електролітична дисоціація”, “ступінь електролітичної дисоціації” та “константа електролітичної дисоціації”. Слід звернути увагу на механізм самого процесу електролітичної дисоціації та на основні положення теорії електролітичної дисоціації С.Арреніуса. Оскільки ступінь електролітичної дисоціації (α) для різних речовин змінюється в межах 0 ≤ α ≤ 1, то необхідно знати межі значень α, що характерні для сильних, середньої сили та слабких електролітів, а також вміти визначати, до яких електролітів (по силі) належить конкретна речовина. Запам’ятайте, що дисоціація – процес оборотний і в разі багатоосновних кислот та багатоосновних основ відщеплюється один іон. Крім того, поняття константи електролітичної дисоціації застосовується тільки для слабких електролітів, тобто для таких систем, у яких молекули непродисоційованих речовин знаходяться в хімічній динамічній рівновазі із своїми іонами. Якщо слабким електролітом є важкорозчинна сполука (осад) – сіль, основа, кислота, то замість поняття “константа електролітичної дисоціації” вводиться поняття “добуток розчинності” (ДР). Необхідно знати, визначення цього поняття, яким чином виводиться воно, від чого залежить і де застосовується. Іонно-молекулярні (іонні) рівняння характеризують стан електроліту в розчині. При складанні цих рівнянь сильні електроліти (кислоти, луги, солі), що повністю дисоціюють, записують у вигляді іонів, а слабкі (важкорозчинні, леткі та прості речовини) – в молекулярній формі. Після виключення в обох частинах рівняння однакових іонів записують скорочене іонно-молекулярне рівняння даної реакції. При цьому необхідно пам’ятати про закон збереження заряду (сума електричних зарядів у лівій і правій частинах рівняння повинна бути однаковою). Знаючи основні положення теорії електролітичної дисоціації, треба вміти виражати суть хімічної взаємодії обмінного типу в розчинах електролітів у вигляді повних та скорочених іонно-молекулярних (іонних) рівнянь.
1.2 Проведення дослідів ЛАБОРАТОРНА РОБОТА №10
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Гідролізом називається обмінна реакція солі з водою, в результаті якої утворюється малодисоційована або малорозчинна сполука і змінюється рН розчину. Згадайте, що водневий показник рН – це від’ємний десятковий логарифм концентрації іонів гідрогену в розчині: рН= - lg[H+]. У нейтральних розчинах [H+]=[ОH-]=10-7 моль/л, рН=7. У
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 616; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.121.231 (0.015 с.) |

 Na[Al (OH4)]
Na[Al (OH4)] Na3[Al (OH6)]
Na3[Al (OH6)]
 Al2O3+2NaOH 2Na[Al (OH4)] натрій метаалюмінат
Al2O3+2NaOH 2Na[Al (OH4)] натрій метаалюмінат Al2O3+СаСО3 Са(AlO2)2+СО2↑ кальцій метаалюмінат
Al2O3+СаСО3 Са(AlO2)2+СО2↑ кальцій метаалюмінат Na+
Na+

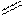 О -Н+
О -Н+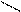 Н3С-С
Н3С-С  СН3СОО -
СН3СОО -

 Н3РО4 Н2РО4- НРО42- РО43-
Н3РО4 Н2РО4- НРО42- РО43-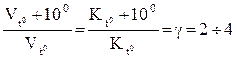
 аA+bB cC+dD
аA+bB cC+dD
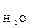 = 1,8 · 10-9. Це означає, що у воді об’ємом 1л (1л містить 55 моль води: 1000 г/ (18г · моль-1) = 55 моль) при 22 0С, стільки 10-7 моль дисоціює на іони:
= 1,8 · 10-9. Це означає, що у воді об’ємом 1л (1л містить 55 моль води: 1000 г/ (18г · моль-1) = 55 моль) при 22 0С, стільки 10-7 моль дисоціює на іони: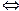 Н+ + ОН-
Н+ + ОН-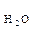 ). При 220С ця величина становить
). При 220С ця величина становить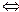 Н+ + А-), концентрація гідроген-іонів у розчині збільшиться. Внаслідок цього рівновага Н2О
Н+ + А-), концентрація гідроген-іонів у розчині збільшиться. Внаслідок цього рівновага Н2О 
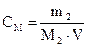

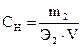


 Ca(HCO3)2 CaCO3 ¯ + H2O + CO2
Ca(HCO3)2 CaCO3 ¯ + H2O + CO2 
 Mg(HCO3)2 Mg(OH)2 ¯ + CO2
Mg(HCO3)2 Mg(OH)2 ¯ + CO2 


