
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 1. Зміщення хімічної рівноваги при зміні концентрації і температури реагуючих речовин.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте а) Налити в пробірку 3-5 мл FeCl3 і стільки ж розчину NH4SCN. Одержаний розчин перемішати і розділити на 4 пробірки. Першу залишити для порівняння, до другої додати 1 краплю концентрованого розчину FeCl3, в третю - кристалічний NH4SCN, в четверту - кристалічний NH4Cl. По зміні забарвлення розчину, обумовленого різною концентрацією ферум роданіда, зробити висновок про напрямок зміщення стану хімічної рівноваги. Сформулювати принцип Ле-Шательє. Записати рівняння реакції:
Вивести константу рівноваги для цього процесу.
б) В інтервалі температур від -11,2 до +140 градусів Цельсію молекули NO2 і N2O4 знаходяться в рівновазі між собою по рівнянню реакції:
Для з’ясування впливу температури на перебіг цього процесу прилад із двома сполученими кульками заповнений сумішшю газів, розміщують таким чином, щоб одна кулька знаходилась у склянці з гарячою водою, друга - в склянці з холодною водою. Газ NO2 - бурого кольору, N2O4 - безбарвний. По зміні забарвлення газів у кульках зробити висновок про зміну концентрації NO2 таким чином, про зміщення положення рівноваги при зміненій температурі. Вивести константу рівноваги процесу димеризаціі двооксиду азоту.
Контрольні питання: 1. Який стан системи називають хімічною рівновагою? 2. Які чинники впливають на зміщення стану хімічної рівноваги? 3. Сформулюйте принцип Ле-Шательє. 4. Вивести константу хімічної рівноваги. ЛАБОРАТОРНА РОБОТА № 5
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Під час хімічних реакцій змінюється не тільки хімічний склад речовин, а й одночасно поглинається або виділяється теплова енергія. Реакції, які супроводжуються зменшенням енергії і виділенням теплоти, називаються екзотермічними, а такі, що супроводжуються збільшенням енергії і поглинанням теплоти – ендотермічними. Хімічні рівняння, в яких вказують тепловий ефект, називають термохімічними рівняннями. Зверніть увагу, що тепловий ефект залежить від кількості речовин, які беруть участь у реакції. Тому для порівняння теплових ефектів їх відносять до І моль сполуки, температури 298 К (25оС) і тиску 760 мм рт. ст. Теплові ефекти за таких умов вважаються стандартними. Якщо в реакції виділяється теплота (+Q), то внутрішня енергія системи, а також ентальпія зменшується (-ΔН), і навпаки, при поглинанні теплоти в реакції (-Q) ентальпія системи збільшується (+ΔН). Теплові ефекти хімічних реакцій вимірюються в джоулях (кілоджоулях). Слід звернути увагу на різницю між поняттями параметри і функції стану системи. Параметри – це фізичні величини, які можливо безпосередньо виміряти, наприклад, тиск, температура, маса. А термодинамічні функції стану, значення яких визначається сукупністю параметрів, безпосередньо виміряти неможливо. Внутрішня енергія і ентальпія є термодинамічними функціями стану системи, оскільки їх зміна не залежить від проходження процесу, а залежить тільки від початкового і кінцевого стану системи. На цьому базується основний закон термохімії – закон Гесса: тепловий ефект реакції залежить тільки від виду і стану вихідних реагентів і кінцевих продуктів реакції, а не залежить від шляху перебігу реакції. При проведенні реакцій у широких температурних інтервалах необхідно враховувати залежність теплового ефекту від температури, що пов’язано з теплоємністю речовин. Розчинення речовин завжди супроводжується тепловим ефектом. Тепловий ефект розчинення твердих речовин, в основному, визначається алгебраїчною сумою двох складових: теплоти, витраченою на руйнування кристалічної решітки (ΔНреш), і теплоти, що виділяється при взаємодії частинок розчиненої речовини з розчинником (ΔНгідр), тобто теплоти гідратації.
ΔНрозч= ΔНреш+ ΔНгідр
Залежно від співвідношення цих двох складових тепловий ефект може бути позитивним або негативним.
Кожна група студентів окремо виконує запропонований викладачем дослід і розраховує його результат. Потім студенти обмінюються результатами проведених досліджень і роблять загальний висновок про характер реакції та виконання закону Гесса.
1.2 Проведення дослідів
|
|||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 563; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

 FeCl3 + 3 NH4SCN Fe (SCN)3 + 3 NH4 Cl
FeCl3 + 3 NH4SCN Fe (SCN)3 + 3 NH4 Cl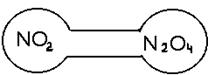
 2 NO2 N2O4 + 58 кДж/моль
2 NO2 N2O4 + 58 кДж/моль


