
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 1. Визначення реакції середовища за допомогою універсального індикаторного паперу.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Шкала універсального індикаторного паперу.
Дослід 2. Визначення реакції середовища невідомих розчинів. Задача 1.
Задача 2.
Контрольні питання:
1. Що таке індикатор? 2. Які іони визначають реакцію середовища? 3. Що таке іонний добуток води? Чому він дорівнює? 4. Що таке водневий показник рН? 5. Які ви знаєте індикатори? Напишіть їх назви. Яке вони мають забарвлення у лужному, нейтральному та кислому середовищі?
ЛАБОРАТОРНА РОБОТА №7
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Більшість хімічних реакцій відбуваються в розчинах при певному оптимальному співвідношенні розчиненої речовини і розчинника. Звернути увагу на приготування розчинів і на розрахунки, що пов’язані з обчисленням концентрації. Розрахункові формули для визначення концентрації розчинів
1.2 Проведення дослідів
Дослід 1. Визначення нормальної концентрації розчину лугу та його титру методом титрування. 1. Набрати 1 мл (нормального) розчину натрій гідроксиду і налити в конічну колбу. До розчину додати краплю індикатора метилоранжу.
2. Налити в бюретку за допомогою воронки розчин натрій гідроксиду (їдкого натрію) так, щоб нижній край меніску знаходився на нульовій відмітці шкали.
3. Титрувати натрій гідроксид розчином сульфатної кислоти. Спостерігати за зміною забарвлення індикатора
4. Припинити титрування в той час, коли колір розчину змінитися з жовтого на рожевий від однієї краплі та визначити об’єм сульфатної кислоти, витрачений на титрування.
5. Визначивши об’єм сульфатної кислоти, витраченої на титрування, розрахувати нормальну концентрацію натрій гідроксиду згідно закону еквівалентів:
n а CнNaOH · VNaOH = Cн
nекв.речовин.
V (л)
ЕNaOH · Сн m(г) речовини
1000 V(мл) речовини
Дослід 2. Визначення маси хлоридної кислоти у розчині невідомої концентрації. 1. Одержати у лаборанта розчин кислоти. Додати до нього 2 краплі метилоранжу та титрувати розчином їдкого натру, концентрація якого визначена у попередньому досліді.
2. Визначити об’єм їдкого натру, витраченого на титрування соляної кислоти. Розрахувати масу соляної кислоти по рівнянню реакції:
HCl + NaOH = NaCl + H2O
з використанням закону еквівалентів: nClекв = nNaOH, а
mHCl
ЕHCl
Контрольні питання: 1. В чому полягає метод титрування? 2. Способи вираження концентрації(С%; СН; СМ; Сm;Т). 3. Як підрахувати еквівалентну масу кислоти, основи, солі? 4. Сформулювати закон еквівалентних мас, його математичний вираз. 5. Використання формули V1C1=V2C2.
ЛАБОРАТОРНА РОБОТА №8
Одним із технологічних показників, який використовують для визначення характеристики якості і складу природних вод є жорсткість води. Жорсткість зумовлена присутністю у воді розчинених кальцієвих та магнієвих солей різних кислот. Здебільшого ці солі представлені у воді катіонами Ca+2, Mg+2 аніонами HCO3 -, SO4 2-, Cl-,CO32-. При вивченні теми слід звернути увагу на класифікацію вод по вмісту солей жорсткості, на причини виникнення жорсткості. Запам'ятати, що згідно ГОСТ 2974-82 допустима жорсткість води для господарсько-питного водопостачання не повинна перевищувати 7 мекв/л. Чому? Розрізняють карбонатну (тимчасову) і некарбонатну (постійну) жорсткість води. Загальна жорсткість - це сума карбонатної та некарбонатної жорсткості води. Карбонатна жорсткість зумовлена присутністю у воді кальцій і магній гідрокарбонатів і може бути частково або повністю усунена нагріванням води до температури вище 60 0С. При цьому відбувається реакція: t
t
Некарбонатну жорсткість воді надають розчинні солі кальцію і магнію та сильних кислот. Ці солі не розкладаються при температурі 60 - 100 градусів, тому пом'якшити таку воду її кип’ятінням неможливо. Усунути або зменшити постійну жорсткість води можна шляхом переводу іонів Ca2+ і Mg2+ в малорозчинні сполуки, якщо додавати до води відповідні хімічні реагенти: Ca(OH)2 , Na2CO3, Na3 PO4 та інші. Запам'ятайте реакції, які відбуваються при цьому:
CaCl2 + Na2 CO3 = CaCO3 ¯ + 2NaCl
3CaCl2 + 2Na3 PO4 = Ca3 (PO4)2 ¯ + 6NaCl
Розберіться, як можна пом'якшити чи знесолити воду методом іонного обміну. Чому цей ефективний метод мало використовується на підприємствах? У методі іонного обміну воду пропускають через іоніти. Це спеціальні тверді речовини, які здатні обмінювати іони, що входять до їх складу на іони, що містяться у воді. Іоніти поділяються на катіоніти (обмінюються катіони) і аніоніти (обмінюються аніони). Для пом'якшення води використовують Na - катіоніти (Na2 R), та H - катіоніти (H2R) i OH - аніоніти (R(OH)2) - для її знесолення. Обмін іонів відбувається в еквівалентних кількостях.
Пом'якшення: CaCl2 + Na2 R = CaR + 2NaCl; MgSO4 + Na2 R = MgR + Na2 SO4; Знесолення: CaCl2 + H2R = CaR + 2 HCl; 2 HCl + R(OH)2= RCl2+ H2O;
Регенерація іонітів здійснюється відповідно розчинами NaCl, HCl i NaOH:
MgR + NaCl = Na2R + MgCl2; CaR + 2HCl = H2R + CaCl2; RCl2 + 2NaOH = R(OH)2 + 2NaCl;
1.2 Проведення дослідів
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 547; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |


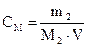

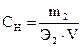

 = nNaOH,
= nNaOH,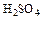 · V
· V  Сн =, а також
Сн =, а також
 його титр за формулою T =; T =
його титр за формулою T =; T = СнNaOH · VNaOH =
СнNaOH · VNaOH =
 Ca(HCO3)2 CaCO3 ¯ + H2O + CO2
Ca(HCO3)2 CaCO3 ¯ + H2O + CO2 
 Mg(HCO3)2 Mg(OH)2 ¯ + CO2
Mg(HCO3)2 Mg(OH)2 ¯ + CO2 


