
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 1. Визначення теплоти нейтралізації концентрованої сірчаної кислоти.Содержание книги
Поиск на нашем сайте
Реакція відбувається за рівнянням:
2NaOH(розб) + Н2SO4(конц) = Na2SO4 + 2H2O + Q
Влити у калориметр 200 мл 0,4 М розчину NaOH, заміряти його початкову температуру, потім додати у калориметр 2 мл конц. H2SO4 (98%). Швидко, але обережно, щоб не пошкодити скло, змішати розчин скляною паличкою і закрити калориметр пробкою з термометром. Зафіксувати кінцеву температуру. Результати вимірювань занести до таблиці:
Розрахунок досліду:
Ср питома теплоємність розчину, яка дорівнює 4,18 Дж/гС; m[NaOH] та m[H2SO4] маси, розраховані за формулою m = pV, де p густина відповідних розчинів; M[H2SO4] мольна маса H2SO4;
Дослід 2. Визначення теплоти нейтралізації розведеної кислоти. Реакція нейтралізації відбувається за рівнянням:
2NaOH(розв) + H2SO4 = Na2SO4 + 2H2O + Q
Влити у калориметр 150 мл 0,2 М розчину H2SO4, заміряти початкову температуру, потім додати 50 мл 1,2 М розчину NaOH, помішуючи скляною паличкою, швидко закрити калориметр пробкою з термометром. Зміряти максимальне значення кінцевої температури. Заповнити таблицю:
Розрахунок досліду:
Cр питома теплоємність розчину, яка дорівнює 4,18 Дж/гС, С[H2SO4] концентрація кислоти, моль/л, m[NaOH] та m[H2SO4] маси розчинів лугу та кислоти, розраховані за формулою m = pV, де p - густина відповідного розчину.
Дослід 3. Визначення теплоти гідратації концентрованої сірчаної кислоти. Реакція гідратації протікає за рівнянням:
H2SO4(конц) + nH2O – H2SO4 x nH2O + Q
У калориметр залити 200 мл дистильованої води, заміряти початкову температуру, потім додати 3 мл конц. сірчаної кислоти, змішати розчин скляною паличкою, закрити пробкою з термометром, зафіксувати кінцеву температуру. Заповнити таблицю:
Розрахунок досліду:
M[H2SO4 ] - мольна маса сірчаної кислоти; розрахована за формулою m = pV
Дослід 4. Визначення теплоти розчинення солі (Na2 S2 O3 ∙ 5H2O). Зважити на технічних терезах 15 г солі, (Na2 S2 O3 ∙ 5 H2 O) розтер-ши її попередньо у порцеляновій ступці. Влити у калориметр 200 мл дистильованої води, заміряти її початкову температуру, потім засипати у калориметр подрібнену сіль, старанно перемішати скляною паличкою, зафіксувати кінцеву температуру (мінімальне значення), щільно прикрив-ши калориметр пробкою з термометром.
Заповнити таблицю:
Розрахунок досліду:
M[Na2S2O3 · 5H2O] - мольна маса солі Na2 S2 O3 · 5H2O
Перевірка результатів. а) Використовуючи данні дослідів 1,2 та 3 перевірити виконання закону Гесса: Q = Q1 + Q2 б) У досліді 4 перевірити узгодження табличного та експериментально одержаного значень: Qтаб. = - 47,2 кДж/моль
Контрольні питання: 1. Що таке тепловий ефект хімічної реакції? 2. Що таке термодинамічна система? 3. Що таке параметри стану системи? (Приклади) 4. Що таке функції стану системи? (Приклади) 5. Від чого залежить тепловий ефект хімічної реакції? 6. Сформулювати закон Гесса, його математичний вираз. ЛАБОРАТОРНА РОБОТА №6
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Вода – слабкий електроліт. Ступінь дисоціації води при 22 0С α Н2О Внаслідок цього утворюється 10-7 моль гідроген-іонів і 10-7 моль гідроксид іонів. Таким чином, концентрація гідроген- і гідроксид-іонів у воді однакові і при температурі 220С дорівнюють [Н+] = [ОН-] = 10-7 моль/л. Добуток концентрацій гідроген- і гідроксид-іонів називають іонним добутком води (I I Іонний добуток води залежить від температури: з її підвищенням він збільшується, із зниженням – зменьшується. Будь-який розчин кислоти, лугу або солі містить гідроген- та гідроксид-іони. Концентрація гідроген-іонів визначає кислотність розчину (середовища), а концентрація гідроксид-іонів – лужність. Розчини, в яких концентрація гідроген- і гідроксид-іонів однакові і дорівнюють 10-7 моль/л, називають нейтральними. Якщо до нейтрального розчину додати кислоту (НА Розчини, в яких концентрація гідроген-іонів перевищує концентрацію гідроксид-іонів [Н+] >[ОН-], називають кислими. Розчини, де концентрація гідроген-іонів меньша, ніж гідроксид іонів [Н+] <[ОН-], є лужними. У кислих і лужних розчинах добуток концентрацій іонів [Н+] [ОН-] – стала величина за сталої температури, [Н+] [ОН-] = 10-14. Тому, знаючи концентрацію одного з цих іонів, можна легко визначити концентрацію іншого. Наприклад, знайдемо концентрацію гідроген- і гідроксид-іонів в 0,01 М розчині HCl. Рівняння дисоціації: HCl [ОН-] = 10-14 /10-2 = 10-12 моль/л Кислотність розчину звичайно виражають через концентрацію гідроген-іонів. Для зручності замість концентрації гідроген-іонів використовують водневий показник рН. Водневий показник рН – це від’ємний десятковий логарифм концентрації гідроген-іонів, рН = - lg [Н+]. Наприклад, при [Н+] = 10-1, рН = 1; при [Н+1] = 10-5, рН = 5 і т.д. Знаючи концентрацію гідроген-іонів, можна визначити рН розчину і навпаки. У нейтральних розчинах [Н+] = [ОН-] = 10-7 моль/л, рН = 7. У кислих розчинах [Н+] >10-7 моль/л, рН < 7. У лужних розчинах [Н+] <10-7 моль/л, рН > 7. Кислотність розчину можна визначити за допомогою індикаторів – речовин, які змінюють свій колір залежно від рН. Зміна кольору індикаторів відбувається в певному інтервалі значень рН. Кожний індикатор характеризується своїм інтервалом переходу (Таблиця 1) Таблиця 1
Існують універсальні індикатори, за допомогою яких можна визначити будь-яке значення рН з точністю до одиниці. Багато промислових, хімічних і біологічних процесів відбуваються лише за певних значень рН розчину.
1.2 Проведення дослідів
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 392; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.208.243 (0.006 с.) |

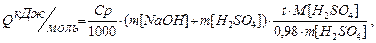 де
де де
де де
де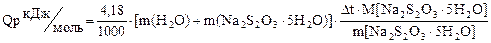
 = 1,8 · 10-9. Це означає, що у воді об’ємом 1л (1л містить 55 моль води: 1000 г/ (18г · моль-1) = 55 моль) при 22 0С, стільки 10-7 моль дисоціює на іони:
= 1,8 · 10-9. Це означає, що у воді об’ємом 1л (1л містить 55 моль води: 1000 г/ (18г · моль-1) = 55 моль) при 22 0С, стільки 10-7 моль дисоціює на іони: Н+ + ОН-
Н+ + ОН-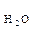 ). При 220С ця величина становить
). При 220С ця величина становить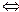 Н+ + А-), концентрація гідроген-іонів у розчині збільшиться. Внаслідок цього рівновага Н2О
Н+ + А-), концентрація гідроген-іонів у розчині збільшиться. Внаслідок цього рівновага Н2О 


