
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослід 2. Основні оксиди та основи.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
а) Прямий метод одержання основ. До 1-2 мл дистильованої води додати 1-2 краплі відповідного індикатора та декілька крупинок CaO. Спостерігати за зміною забарвлення індикатора. Написати рівняння реакції гідратації оксиду.
б) Непрямий (посередній) метод одержання основ. Переконатися, що CuO не розчиняється у воді. Чи можна одержати купрум (ІІ) гідроксид прямим методом? Одержати купрум (ІІ) гідроксид посереднім методом - діючи лугом на сіль міді. Написати рівняння реакції одержання Cu(OH)2. Порівняти колір осадів купрум (ІІ) оксиду та купрум (ІІ) гідроксида. Зберегти осад для наступного досліду.
Контрольні питання: 1. Дайте визначення оксидам та основам, їх класифікація. Наведіть приклади. 2. Методи одержання оксидів та основ (рівняння реакцій).
ЛАБОРАТОРНА РОБОТА №2
1.1 Методичні вказівки до вивчення теоретичного матеріалу
Кислотами називають складні речовини загальної формули HXEYOZ (E – елемент). Кислоти, молекули яких не містять атомів кисню, називають безкисневими, наприклад, HCl – хлоридна (хлорводнева), H2S – сульфідна (сірководнева) та ін. Однією з основних характеристик кислот є їх основність. Основність кислоти – це кількість атомів водню в кислоті, здатних заміщуватись у хімічних реакціях. Негативні іони, що залишаються в молекулі кислоти після відщеплення одного або кількох іонів водню називаються кислотними залишками. Основні кислоти утворюють один кислотний залишок, а дво- чи триосновні – два чи три кислотні залишки. Наприклад, ацетатна (оцтова) кислота є одноосновною, оскільки у водних розчинах в її молекулі може заміщуватись лише один Н+-іон. При цьому утвориться один кислотний залишок.
О-Н ацетат-іон
Для багатоосновних кислот процес заміщення Н+-іонів відбувається ступінчасто:
-Н+ -Н+ -Н+
утворюються утворюються кислі солі середні солі
Кислоти та їх залишки
Найхарактернішою ознакою кислот є їх здатність утворювати солі при взаємодії з основами (реакція нейтралізації), основними оксидами і металами. Солі – це сполуки, до складу яких входять катіони металів та аніони кислотних залишків. Солі бувають середні, кислі і основні. Середні солі можна розглядати як продукти повного заміщення водню кислоти металом, наприклад, Al2(SO4)3, MgCl2. Кислі солі – продукти неповного заміщення водню багатоосновної основи на кислотні залишки, наприклад, Mg(НSO4)2, Ca(HSO4)2. Основні солі – продукти неповного обміну гідроксогруп (ОН-) багатокислотної основи на кислотні залишки, наприклад, CuOHCl, Al(OH)2Cl. Існує багато методів добування солей, які детально описані в літературі. Зверніть увагу на те, що за реакцією нейтралізації можна добути (залежно від молярних співвідношень реагентів) як середні, так і кислі та основні солі.
2Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O алюміній сульфат 2Al(OH)3 + 3 H2SO4 = Al2(НSO4)3 + 3 H2O алюміній гідросульфат 2Al(OH)3 + H2SO4 = [ Al(OH)2]2 SO4 + 2 H2O алюміній дигідроксосульфат Al(OH)3 + H2SO4 = Al(ОН)SO4 + 2 H2O алюміній гідроксосульфат Для перетворення кислих і основних солей в середні треба подіяти на них відповідно основою або кислотою. Назви солей складаються з назви хімічного елементу і назви кислотного залишку в називному відмінку і залишку в родовому відмінку. Багато солей мають також технічну назву.
1.2 Проведення дослідів
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 443; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.195.4 (0.009 с.) |

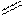 О -Н+
О -Н+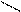 Н3С-С
Н3С-С  СН3СОО -
СН3СОО -

 Н3РО4 Н2РО4- НРО42- РО43-
Н3РО4 Н2РО4- НРО42- РО43-


