
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення маси цинку методом витісненняСодержание книги
Поиск на нашем сайте
ЛАБОРАТОРНА РОБОТА 1 ВИЗНАЧЕННЯ МАСИ ЦИНКУ МЕТОДОМ ВИТІСНЕННЯ
Прилад для визначення маси цинку складається з бюретки та лійки, закріплених на штативі та сполучених одне з одним за допомогою гумової рубки. До бюретки на пробці приєднана пробірка, що має у верхній частині невелике заглиблення. Бюретка та лійка заповнені водою. Перед дослідом необхідно перевірити герметичність приладу. Для цього підніміть лійку вгору, якщо впродовж 1-2 хв рівень води в бюретці не підіймається, то можна вважати прилад герметичним. У противному разі необхідно ущільнити пробки на місцях з’єднання. Виставте на однаковій висоті рівні води в бюретці та пробірці й закріпіть їх у такому положенні. Запишіть показник рівня води в бюретці з точністю до 0,05 мл. Не забудьте при цьому, що для правильного відліку око спостерігача повинно знаходитись на одному рівні з нижнім меніском рідини в бюретці. У пробірку налийте 3-4 мл розбавленої хлоридної кислоти так, щоб не змочити розчином заглиблення у верхній частині пробірки (якщо це сталося, протріть його насухо фільтрувальним папером). Отримайте в лаборанта наважку металу. Пробірку з кислотою нахиліть і обережно (слідкуючи за тим, щоб шматочки металу не потрапили в кислоту) помістіть наважку металу в заглиблення на стінці пробірки. Тримаючи пробірку в нахиленому положенні, міцно закрийте її пробкою приладу, а потім, струшуючи, змийте шматочки металу в кислоту. Простежте за виділенням водню й витісненням води з бюретки в лійку. Після закінчення реакції слід зачекати, доки температура газу стане кімнатною і рівень рідини в бюретці буде постійним. Після цього доведіть воду в бюретці й лійці до одного рівня, тим самим створивши в бюретці тиск, що дорівнює атмосферному. Запишіть висоту рівня води в бюретці, а також температуру й тиск за барометром. За даними досліду обчисліть масу цинку, який прореагував із хлоридною кислотою. При цьому необхідно врахувати, що водень, який виділяється під час реакції, містить домішки водяної пари. Тому тиск газу в системі дорівнює сумі парціальних тисків водню й насиченої водяної пари Р = р(Н2) + р(Н2О) У табл.1 наведені значення парціального тиску насиченої водяної пари при різних температурах. У процесі розрахунку маси чи об’єму водню за газовими законами застосовують значення р(Н2). Обчисліть масу цинку двома способами (за масою водню та його об’ємом).
Таблиця 1 Тиск насиченої водяної пари при різних температурах
Запишіть дані досліду та результати розрахунків у таблицю:
ЛАБОРАТОРНА РОБОТА 2 ВИВЧЕННЯ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК
Запропоновані завдання розкривають та ілюструють теоретичні знання, розвивають навички хімічного експерименту. Кожному студенту дають окремий варіант завдання. Перш ніж виконувати експериментальну частину уважно прочитайте завдання та складіть детальний план роботи. Досліди проводьте в пробірках, реактиви додавайте обережно, кількома краплями. Кожен наступний етап роботи виконуйте після перенесення частини реакційної суміші в іншу пробірку. Для вивчення властивостей малорозчинних сполук після утворення осадів дайте суміші відстоятися, злийте обережно розчин і розділіть осад на декілька проб. Уважно спостерігайте та фіксуйте в лабораторному журналі ефекти, які супроводжують перебіг кож-ної реакції. Складіть рівняння цих реакцій у молекулярній та йонно-молекулярній формах. Варіант 1 1.Дослідним шляхом визначте за характерними реакціями та доведіть, у яких пробірках містяться розчини: натрій хлориду, натрій гідроксиду, хлоридної кислоти. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
Варіант 2 1.Дослідним шляхом визначте й доведіть, у яких пробірках містяться розчини: натрій хлориду, амоній хлориду, натрій карбонату. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення: мідь ® купрум (ІІ) оксид ® купрум (ІІ) хлорид ® купрум (ІІ) гідроксид ® купрум (ІІ) сульфат ® купрум (ІІ) хлорид ® аргентум хлорид. Варіант 3 1.Дослідним шляхом визначте та доведіть, у яких пробірках містяться розчини: ферум (ІІ) сульфату, алюміній сульфату, ферум (ІІІ) хлориду. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення: залізо ® ферум (ІІ) хлорид ® ферум (ІІ) гідроксид ® ферум (ІІІ) гідроксид® ферум (ІІІ) оксид ® ферум (ІІІ) сульфат ® ферум (ІІІ) хлорид. Варіант 4 1.Дослідним шляхом визначте та доведіть, у яких пробірках містяться кристалічні солі: натрій сульфат, натрій хлорид, натрій йодид. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
цинк®цинк хлорид®цинк гідроксид
Варіант 5 1.Дослідним шляхом визначте та доведіть, у яких пробірках містяться розчини солей: натрій сульфату, натрій сульфіду, натрій сульфіту. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
Pb ® Pb(NO3)2 ® Pb(OH)2
+Al ¯ Б Варіант 6 1.Дослідним шляхом визначте за характерними реакціями та доведіть, у яких пробірках містяться розчини: нітратної кислоти, натрій гідроксиду, сульфатної кислоти. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
Na[Al(OH)4]
ЛАБОРАТОРНА РОБОТА 3 СИЛЬНОЮ КИСЛОТОЮ
Досліди, пов’язані з експериментальним визначенням теплових ефектів хімічних процесів, проводять за допомогою калориметра, що складається з двох склянок (100 і 250 мл), вставлених одна в одну. Калориметр накривають кришкою з отворами для мішалки й термометра. Зважте внутрішню склянку калориметра. Налийте в неї мірною колбою 50 мл 1М розчину хлоридної кислоти. Помістіть склянку з кислотою в зовнішню склянку калориметра й виміряйте температуру кислоти з точністю до 0,05°С. У склянку місткістю 100 мл відміряйте 50 мл 1М розчину натрій гідроксиду і також визначте його температуру. Перемістіть розчин за допомогою лійки в калориметр, перемішуючи при цьому його вміст. Прослідкуйте, якою буде максимальна температура, на термометрі після злиття розчинів. Дані досліду запишіть у журнал у такій формі:
Обчисліть, яка кількість теплоти виділилася внаслідок реакції, за формулою: Q = (mрCр + mскCск)×Dt; Dt = tкінц. – tпоч., де tпоч. і tкінц. – початкова й кінцева температури в калориметричній склянці; mск і mр – маси склянки й рідини в ній відповідно; Сск і Ср – питомі теплоємності скла й рідини відповідно. У розрахунках припускається, що густина розчину дорівнює 1 г/см3; його питома теплоємність дорівнює теплоємності води, тобто 4,184 Дж/г×К; питома теплоємність скла – 0,753 Дж/г×К. Обчисліть теплоту нейтралізації з розрахунком на 1 моль кислоти. Визначте відносну похибку досліду, якщо відомо, що під час нейтралізації 1 моля сильної одноосновної кислоти лугом виділяється 57,36 кДж тепла.
ЛАБОРАТОРНА РОБОТА 4 Й СУЛЬФАТНОЇ КИСЛОТИ Унаслідок взаємодії сульфатної кислоти з натрій тіосульфатом виділяється сірка у вигляді муті. Напишіть рівняння реакцій, що відбуваються. Час від початку реакції до появи перших слідів муті залежить від концентрацій реагуючих речовин. Три бюретки заповніть по черзі: першу – водою, другу – розчином натрій тіосульфату, третю – розчином сульфатної кислоти. У чотири пронумеровані пробірки налийте вказані в таблиці кількості розчину тіосульфату й води. В інші чотири пробірки відміряйте бюреткою по 4 мл розчину сульфатної кислоти. Налийте в першу пробірку відміряну кількість сульфатної кислоти, швидко перемішайте й визначте за секундоміром час від моменту злиття розчинів до появи муті в пробірці. Швидкість реакції визначте як величину, обернено пропорційну знайденому часові. Дані досліду запишіть у таблицю:
Аналогічно проведіть досліди з іншими пробірками. Залежність між зміною концентрації розчину й швидкістю реакції зобразьте графічно. На осі абсцис відкладіть величину концентрації розчину, на осі ординат – величину швидкості реакції. Визначте, яка лінія відповідає знайденій залежності.
ЛАБОРАТОРНА РОБОТА 5 І газоподібних речовин 1.До 1 мл розчину натрій ацетату додайте 1 мл розбавленої сульфатної кислоти. Зверніть увагу на появу запаху. 2.До 1 мл розчину амоній хлориду додайте такий же об’єм розчину натрій (калій) гідроксиду. Зверніть увагу на появу запаху. Вміст пробірки нагрійте й піднесіть до її отвору змочену рожеву лакмусову смужку. Прослідкуйте за реакцією. 3.До 1 мл розчину натрій карбонату додайте 1 мл розчину хлоридної кислоти. Прослідкуйте за результатом. 4.До 1 мл розчину натрій гідроксиду додайте 1-2 краплини метилоранжу, а потім по краплині підливайте розбавлений розчин хлоридної кислоти, доки не утвориться оранжево-жовте забарвлення. Повторіть дослід, змінивши розчин натрій гідроксиду на розчин аміаку. ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Окисники – прості речовини 1.До хлорної води додайте розчин калій броміду. В отриманий розчин долийте 1 мл карбон (IV) хлориду та збовтайте. Прослідкуйте за реакцією. Для порівняння до кількох мілілітрів бромної води додайте 1 мл карбон (IV) хлориду та збовтайте. 2.До розчину калій йодиду додайте бромну воду. Екстрагуйте йод, що виділився, карбон (IV) хлоридом (зверніть увагу на забарвлення). Окисно-відновних реакцій У три пробірки налийте розчин калій перманганату. У першій пробірці розчин підкисліть розбавленою сульфатною кислотою, у другу додайте концентрований розчин калій гідроксиду (30%), а в третій – розчин розведіть водою до такого ж об’єму. У всі пробірки додайте натрій сульфіт. Враховуйте, що солі манґану (ІІ) в розчині практично безбарвні, аніон MnO42− - зеленого кольору, а MnO2 – бурий осад, зробіть висновок щодо перетворень перманґанат-іона залежно від середовища. Обчисліть окисно-відновні еквіваленти калій перманґанату і натрій сульфіту. Усі рівняння окисно-відновних реакцій повинні бути записані в іонній та молекулярній формах.
ЛАБОРАТОРНА РОБОТА 9 ГІДРОГЕН, ОКСИГЕН Отримання водню 1. Дія металу на кислоту. У пробірку покладіть декілька гранул цинку, додайте 2 мл розчину сульфатної кислоти з молярною концентрацією еквівалентів 4 моль/л і закрийте отвір пробірки пробкою з газовідвідною трубкою. Перевірте водень на чистоту. Для цього на кінець трубки надіньте пробірку, яку через кожні 2 хв знімайте і, не перевертаючи, підносьте до полум’я. Чистий водень горить спокійно, змішаний із киснем дає слабкий вибух. Якщо водень, що виділяється, чистий, то підпаліть його запаленою скіпкою (у присутності лаборанта) біля отвору газовідвідної трубки. Над полум’ям водню потримайте холодну скляну лійку. Прослідкуйте за цим процесом. Напишіть рівняння реакцій. 2. Дія металу на луг. Покладіть у пробірку декілька шматочків алюмінію і долийте 2 мл розчину натрій гідроксиду з молярною концентрацією еквівалентів 2 моль/л. Який газ виділяється? Напишіть рівняння реакції. 3. Дія металу на воду. Заповніть пробірку вщент водою. Закрийте отвір пальцем, занурте в кристалізатор із водою і в такому стані закріпіть у лапці штатива. Загорніть шматочок металічного кальцію в марлю і швидко за допомогою пінцета внесіть метал у пробірку. З’ясуйте, який газ виділяється. Напишіть рівняння реакції. Отримання кисню Прожарте в окремих пробірках манґан (IV) оксид, калій нітрат, калій перманґанат. Простежте за реакцією. Визначте за допомогою скіпки, чи виділяється кисень. Напишіть рівняння реакцій. ЛАБОРАТОРНА РОБОТА 10 ПІДГРУПА ГАЛОГЕНІВ
Отримання хлору 1.В окремі пробірки внесіть по одному мікрошпателю манґан (IV) оксиду, плюмбум (IV) оксиду, калій біхромату і калій перманґанату. У кожну з них долийте по 2–3 мл концентрованої хлоридної кислоти. Ті пробірки, у яких реакція відбувається повільно, обережно підігрійте. Зверніть увагу на колір газу, що утворюється і дослідіть його дію папірцем, змоченим розчином калій йодиду. Напишіть рівняння реакцій. 2.Змішайте в пробірці по одному мікрошпателю натрій хлориду й манґан (IV) оксиду, після чого додайте в суміш 1–2 мл концентрованої сульфатної кислоти (дуже обережно) і підігрійте. Як діє утворений газ на папірець, змочений розчином калій йодиду? Напишіть рівняння реакції. Отримання брому 1.У пробірці змішайте декілька кристалів калій броміду з невеликою кількістю манґан (IV) оксиду, додайте 1–2 мл концентрованої сульфатної кислоти й обережно підігрійте. Прослідкуйте за виділенням брому. Напишіть рівняння реакції. 2.До 2–3 мл розчину калій броміду долийте краплями хлорну воду. Простежте за зміною забарвлення розчину. Напишіть рівняння реакції. Потім до розчину додайте бензол, збовтайте, дайте розчину відстоятись. Зверніть увагу на забарвлення органічного шару. Отримання йоду 1.У пробірці змішайте декілька кристалів йодиду з невеликою кількістю манґан (IV) оксиду, долийте 1–2 мл концентрованої сульфатної кислоти й підігрійте. Простежте за утворенням фіолетової пари йоду. Напишіть рівняння реакції. 2.До розчину калій йодиду долийте краплями хлорну воду. Доведіть наявність йоду в розчині за допомогою крохмального клейстеру. Напишіть рівняння реакції. Властивості йоду У суху пробірку всипте декілька кристалів йоду й обережно нагрійте. Прослідкуйте за утворенням фіолетової пари йоду (сублімацією) і осіданням його (десублімацією) на холодних стінках пробірки. Після охолодження долийте в пробірку 2–3 мл дистильованої води і збовтайте. Вода забарвлюється в світло-жовтий колір. Опишіть, як розчиняється йод у воді. Додайте в пробірку декілька кристалів калій йодиду. Визначте, як і чому змінюється при цьому розчинність йоду. Властивості хлорної води 1.Налийте в пробірку 2–3 мл хлорної води, обережно визначте колір і запах розчину. Які речовини наявні в хлорній воді? Додайте по краплях розчин калій гідроксиду. Поясніть зникнення забарвлення й запаху хлорної води. Додайте в пробірку розчин сульфатної кислоти з молярною концентрацією еквівалентів 2 моль/л до кислої реакції середовища. Визначте, чи змінився запах розчину. Напишіть рівняння реакцій. З’ясуйте, як впливає луг та кислота на зміщення рівноваги між хлором та водою. 2.До 2–3 мл розчину манган (ІІ) сульфату долийте рівний об’єм хлорної води і 3 мл розчину лугу. Визначте склад і колір утвореного осаду. Напишіть рівняння реакції. ЛАБОРАТОРНА РОБОТА 11 СУЛЬФУР
Відновні властивості сірки (Тяга!) У пробірку покладіть невелику кількість порошку сірки й долийте 1–2 мл концентрованої нітратної кислоти. Нагрійте суміш до кипіння. Дайте розчину охолонути, профільтруйте. До фільтрату додайте розчин барій хлориду. Укажіть, про наявність якого йона в розчині свідчить утворений білий осад. Напишіть рівняння реакцій. Одержання сульфідів металів Налийте в пробірки по 1–2 мл розчинів солей: купруму (ІІ), феруму (ІІ), стибію (ІІІ), бісмуту (ІІІ), плюмбуму (ІІ), цинку, манґану (ІІ), кадмію, кальцію, натрію і до кожного з них додайте сірководневу воду. Прослідкуйте за реакцією. Визначте, в яких пробірках утворились осади і якого вони кольору. Напишіть рівняння реакцій. На розчини солей, які не дали осад, подійте розчином амоній сульфіду. Опишіть спостереження та рівняння реакцій. Дайте класифікацію сульфідів, розподіливши їх на три групи: а)катіони, які осаджуються гідроген сульфідом; б)катіони, які не осаджуються гідроген сульфідом, але осаджуються амоній сульфідом; в)катіони, які не осаджуються амоній сульфідом. Застосовуючи довідникові дані, розрахуйте розчинність відповідних сульфідів. ЛАБОРАТОРНА РОБОТА 12 СПОЛУКИ НІТРОГЕНУ Отримання аміаку Приблизно рівні кількості подрібнених амоній хлориду та гашеного вапна добре перемішайте в порцеляновій ступці. Зверніть увагу на запах суміші. Перенесіть суміш у суху пробірку й нагрійте. До отвору пробірки піднесіть вологий індикаторний папір. Чому і як змінюється колір індикаторного паперу? Напишіть рівняння реакції. Рівновага в розчині аміаку Розлийте розбавлений розчин аміаку з молярною концентрацією еквівалентів 2 моль/л у чотири пробірки. Додайте в кожну з них по 3–4 краплі розчину фенолфталеїну. Розчин у першій пробірці прокип’ятіть. У другу пробірку насипте амоній хлорид і збовтайте розчин, у третю – кілька крапель хлоридної кислоти з молярною концентрацією еквівалентів 2 моль/л. Четверту пробірку залиште для порівняння. Поясніть вплив температури, додавання амоній хлориду й хлоридної кислоти на рівновагу: NH3 + H2O «NH3×H2O «NH4+ + OH- Визначення амонійних солей До 1 мл розчину амоній хлориду або сульфату додайте рівний об’єм розчину калій гідроксиду, нагрійте до кипіння. Доведіть утворення й виділення аміаку. Напишіть рівняння реакції. Утворення амоній хлориду У стакан на 500 мл налийте трохи концентрованої хлоридної кислоти. Обертайте стакан так, щоб дно й стінки його були змочені кислотою. Надлишок кислоти вилийте. Налийте в тигель трохи концентрованого розчину аміаку, накрийте його стаканом із хлоридною кислотою. Поясніть появу білого диму. Напишіть рівняння реакції. Відновні властивості аміаку До бромної води долийте розчин аміаку. Розчин знебарвлюється і виділяється газ (укажіть який). У надлишку аміаку утворюється білий дим. Аналогічний дослід проведіть з йодною водою. Напишіть рівняння реакцій. Окисні властивості нітритів До 1–2 мл розчину калій йодиду, підкисленого розбавленою сульфатною кислотою, додайте розчин натрій або калій нітриту. Поясніть появу бурого забарвлення розчину. Напишіть рівняння реакції. Окисні властивості нітратів У порцелянову чашку насипте невелику кількість калій або натрій нітрату, нагрійте до розплавлення солі й, не припиняючи нагрівання, додайте до розплаву (дуже обережно) сірку та вугілля. Поясніть, що відбувається. Напишіть рівняння реакції.
ЛАБОРАТОРНА РОБОТА 13 ФОСФОР КАРБОН, СИЛІЦІЙ Отримання вугілля з цукру У ступці подрібніть 2–3 г цукру й покладіть у тигель, нагрійте. Прослідкуйте спочатку за розплавленням, а потім обвуглюванням цукру. Обвуглену масу прожарте й охолодіть. Вугілля використайте для подальших дослідів. БОР Отримання борної кислоти У пробірку з 3–4 мл гарячого насиченого розчину бури (Na2B4O7) додайте 1–2 мл концентрованої сульфатної кислоти. Укажіть, що спостерігаєте. Напишіть рівняння реакції. Властивості борної кислоти 1. Розклад борної кислоти. У тигель покладіть декілька кристалів борної кислоти й нагрівайте її. Потримайте над тиглем синій кобальтовий папір. Укажіть, як змінився його колір. Нагрійте тигель сильніше до припинення виділення пари води та утворення борного ангідриду. 2. Дослідження розчинності й кислотних властивостей борної кислоти. Невелику кількість кристалів борної кислоти внесіть у пробірку й долийте 5–6 мл води, розмішайте скляною паличкою і зазначте погану розчинність H3BO3 у холодній воді. Нагрійте пробірку на невеликому полум’ї. Визначте, як змінюється розчинність при нагріванні. Після охолодження визначте рН розчину борної кислоти. У пробірку з розчином борної кислоти додайте магнієві ошурки. Напишіть рівняння реакції взаємодії борної кислоти з магнієм, якщо утворюється магній метаборат. Солі борних кислот 1. Гідроліз натрій тетраборату. За допомогою універсального індикаторного паперу визначте рН 0,5М розчину бури. Напишіть рівняння гідролізу. Визначте, як можна посилити гідроліз бури. 2. Отримання малорозчинних метаборатів барію та аргентуму. У дві пробірки з насиченим розчином натрій тетраборату долийте: в першу – розчин солі барію (якщо осад не утворюється, додайте 2 краплі аміаку), в другу – солі аргентуму. Визначте колір і характер осадів. Напишіть рівняння реакцій. Взаємодія натрію з киснем Шматочок натрію висушіть фільтрувальним папером від гасу й покладіть у тигель. Нагрійте тигель (тяга). Натрій із киснем утворюють у результаті згоряння натрій пероксид. Напишіть рівняння реакцій. Збережіть натрій пероксид для подальших дослідів. Гідроліз солей За допомогою універсального індикаторного паперу визначте рН 0,1М розчинів натрій нітрату, сульфіду, калій хлориду й карбонату. Напишіть рівняння реакцій. Взаємодія кальцію з водою У пробірку залийте дистильовану воду й покладіть маленький шматочок металічного кальцію. Прослідкуйте за виділенням газу. Якщо реакція відбувається повільно, пробірку підігрійте. Додайте в розчин 1−2 краплі фенолфталеїну. Укажіть, про що свідчить забарвлення розчину. Напишіть рівняння реакцій. Дія кислот на алюміній У три пробірки покладіть по шматочку металічного алюмінію й додайте в одну з них 3−4 мл розчину хлоридної кислоти з молярною концентрацією еквівалентів 2 моль/л, у другу – сульфатної кислоти такої ж концентрації, у третю – концентрованої сульфатної кислоти. Порівняйте активність взаємодії алюмінію з хлоридною та сульфатною кислотами на холоді. Нагрійте пробірки з розбавленими кислотами. Обережно нагрійте пробірку з концентрованою кислотою. Опишіть свої спостереження та рівняння реакцій. Взаємодія алюмінію з лугом У дві пробірки покладіть по 2 шматочки алюмінію й додайте в одну пробірку 2 мл хлоридної кислоти з молярною концентрацією еквівалентів 2 моль/л, у другу – 2 мл розчину натрій гідроксиду. У якій із пробірок алюміній розчиняється швидше? Відповідь обґрунтуйте виходячи зі значень електродних потенціалів алюмінію та водню в розчинах з різним значенням рН. Напишіть рівняння реакцій. МОЛІБДЕН МАНГАН ФЕРУМ, КОБАЛЬТ КУПРУМ Купрум (І) йодид До розчину купрум (ІІ) сульфату додайте 1−2 мл води й долийте розчин калій йодиду. Частину отриманої суміші відлийте в другу пробірку й додайте хлороформ, збовтайте. Зазначте виділення йоду. Щоб позбутися йоду, який маскує осад купрум (І) йодиду, додайте в першу пробірку декілька крапель розчину крохмалю й розчин тіосульфату до зникнення синього забарвлення. Уникайте надлишку тіосульфату, бо він розчиняє і купрум (І) йодид. Напишіть рівняння реакцій. ЦИНК Добування цинк гідроксиду До розчину солі цинку долийте спочатку невелику кількість калій гідроксиду, а потім – надлишок. Укажіть, які властивості гідроксиду ілюструють ці реакції. Напишіть рівняння реакцій. Проведіть аналогічний дослід, замінивши розчин калій гідроксиду на розчин аміаку. Поясніть, чому цинк гідроксид розчиняється в надлишку аміаку. Напишіть рівняння реакції. Неметали 1. Поясніть, чому Д.І.Менделєєв розміщував Гідроген у першій та в сьомій групах періодичної системи? 2. Назвіть основні способи добування водню в промислових умовах та в лабораторії. Напишіть рівняння відповідних хімічних рівнянь. 3. Які ступені окиснення характерні для Гідрогену в його сполуках? Чи може Гідроген бути двовалентним? Наведіть приклади. 4. Наведіть класифікацію бінарних водневих сполук. Які типи хімічного зв’язку утворює Гідроген у цих сполуках? 5. З якими складними речовинами взаємодіє водень? Оксиди яких металів можна відновлювати за його допомогою? 6. Чому для атомів галогенів більш характерні непарні ступені окиснення? 7. Як і чому змінюється окиснювальна здатність галогенів у ряді F – At? Чи можуть галогени у вільному стані бути відновниками в хімічних реакціях? 8. З якими простими та складними речовинами можуть взаємодіяти галогени? Напишіть рівняння хімічних реакцій. 9. Як і чому змінюється сила гідрогенгалогенідних кислот від HF до HI? 10. Як і чому змінюється відновна здатність у ряді HF − HI? Наведіть приклади, які ілюструють ці зміни. 11. Чому під час добування гідроген броміду та гідроген йодиду в лабораторії діють ортофосфатною кислотою, а не концентрованою сульфатною кислотою? 12. Напишіть електронні формули Флуору, Хлору, Брому та поясніть: а) що спільного та відмінного в електронній будові атомів галогенів; б) який найвищий та найнижчий ступені окиснення проявляють галогени в сполуках. 13. За допомогою яких реакцій можна здійснити такі перетворення:
KClO3®KClO4®HClO4®Cl2O7. 14. Напишіть рівняння хімічних реакцій: а)KMnO4 + KI + H2SO4 ® б)NaCl + H2SO4(конц) ® в)KClO3 + HCl(конц) ® г)NaI + H2SO4(конц) ® д)K2Cr2O7 + HCl(конц) ® е)PbO2 + HBr ® 15. Напишіть рівняння хімічних реакцій: а)NaF + H2SO4(конц) ® б)MnO2 + KBr + H2SO4 ® в)NaBr + H2SO4(конц) ® г)CaOCl2 + HCl ® д)MnO2 + HCl ® е)KBr + Cl2 ® 16. З мірної колби об’ємом 1 л відібрали 10 мл розчину аргентум нітрату та додали розчин натрій хлориду в надлишку (до припинення утворення білого осаду та ще трохи). Маса утвореного осаду 0,143 г. Обчисліть молярну концентрацію аргентум нітрату у вихідному розчині. 17. Який об’єм гідроген хлориду (н.у.) необхідно розчинити в 1 м3 води для добування розчину хлоридної кислоти з масовою часткою розчиненої речовини 8% з густиною 1,038 г/см3? Обчисліть молярну концентрацію гідроген хлориду в розчині. 18. Який об’єм розчину натрій гідроксиду (ρ=1,285 г/см3) з масовою часткою лугу 26% (враховуючи 30% надлишок) потрібно взяти для реакції з кремнієм, щоб одержаного газу вистачило для добування кальцій гідриду масою 4,2 г? 19. Газ, одержаний у результаті розчинення кальцій гідриду у воді, пропустили над розжареним ферум (ІІ) оксидом. Маса оксиду при цьому зменшилась на 25 г. Обчисліть масу кальцій гідриду, який витратили на реакцію. 20. Який об’єм водню (н.у.) потрібно використати для відновлення металів із суміші їх оксидів (NiO та CuO) масою 20,7 г? Відомо, що кількості речовин оксидів у вихідній суміші відносились як 2:1. 21. На відновлення суміші ферум (ІІІ) оксиду та цинк оксиду масою 40,1 г витратили 0,7 моля водню. Визначте масовий склад вихідної суміші. 22. Продукт, одержаний при взаємодії 10 л водню (н.у.) та 28 г хлору, розчинили у воді об’ємом 200 мл. Розрахуйте масову частку речовини в одержаному розчині. 23. У воді об’ємом 0,5 л розчинили 0,4 г калій хлориду, 15 г натрій хлориду та 1,8 г магній хлориду. Скільки грамів хлорид-іонів міститься в 100 мл води? 24. Який об’єм хлору (н.у.) потрібно використати для витіснення йоду з калій йодиду, що мітиться в розчині солі масою 0,5 кг з масовою часткою калій йодиду 4%? 25. У склянку, в якій було 300 г хлоридної кислоти з масовою часткою гідроген хлориду 20%, помістили цинкову пластинку. Коли її дістали, то виявилось, що її маса зменшилась на 9,75 г. Яка масова частка кислоти в одержаному розчині? 26. Визначте масу піролюзиту, масова частка манґан (IV) оксиду в якому становить 80%, та об’єм хлоридної кислоти (w=0,2; r=1,1 г/см3), які потрібно використати для добування хлору масою 14,2 кг. Вихід продукту становить 85%. 27. Які маси червоного фосфору та калій хлорату (V) були використані для добування фосфор (V) оксиду, якщо відомо, що при розчиненні цього оксиду в 200 г розчину ортофосфатної кислоти (w=10%) масова частка кислоти збільшилась на 4%. 28. Хлор, одержаний у результаті повного електролізу 400 мл 2М розчину натрій хлориду, пропустили через гарячий розчин натрій гідроксиду об’ємом 600 мл (ρ=1,225 г/см3) з масовою часткою лугу 20%. Розрахуйте масові частки речовин у одержаному розчині. 29. У хлоридну кислоту, одержану при розчиненні 1,64 моля гідроген хлориду в 240,14 мл води, помістили цинкову пластинку. Через деякий час її вийняли. Виявилось, що її маса зменшилась на 13 г. Розрахуйте масові частки речовин у одержаному розчині. 30. У процесі взаємодії надлишку хлоридної кислоти із сумішшю цинку та цинк карбонату масою 63 г утворилось 13,44 л (н.у.) газів. Визначте: а) масову частку цинку у вихідній суміші; б) масу осаду, який утвориться при пропусканні одержаної газової суміші через баритову воду об’ємом 300 мл з концентрацією лугу 1,5 моль/л. 31. Газ, одержаний у результаті термічного розкладу калій нітрату масою 60,6 г, змішали з газом, одержаним при дії надлишку розчину натрій гідроксиду на цинк масою 97,5 г. Суміш привели до умов реакції. Визначте масу одержаного продукту. 32. Визначте, який об’єм займе при температурі 20°С і тиску 120 кПа кисень, що виділиться при повному розкладі гідроген пероксиду, який міститься в 250 г розчину з масовою часткою речовини 3%? 33. Через розчин калій гідроксиду об’ємом 250 мл з молярною концентрацією лугу 1 моль/л пропустили 5,6 л сульфур (IV) оксиду (н.у.). Яка сіль і якою масою при цьому утворилась? 34. Суміш натрій сульфату, натрій нітрату та натрій хлориду масою 103,2 г розчинили у воді. До розчину долили надлишок розчину барій нітрату. При цьому випало 69,9 г осаду, який відокремили. До фільтрату долили надлишок розчину аргентум нітрату. Утворився осад масою 86,1 г. Обчисліть масові частки солей у вихідній суміші. 35. Яку масу натрій сульфат декагідрату потрібно додати до 250 мл розчину натрій сульфату з масовою часткою речовини 5% (r=1,01 г/см3), щоб подвоїти масову частку солі? 36. Газ, одержаний у результаті обпалювання 1,92 кг піриту, окиснили в контактному апараті киснем. Масова частка домішок у піриті становила 15%. Продукт реакції окиснення розчинили в 21,2 кг розчину сульфатної кислоти з масовою часткою речовини 60%. До одержаного розчину додали надлишок розчину барій нітрату. Визначте масу осаду, що при цьому утворився. 37. Газ, одержаний при взаємодії 12,6 г натрій сульфіту з хлоридною кислотою масою 600 г з масовою часткою гідроген хлориду 20%, ввели в реакцію з іншим газом, одержаним при взаємодії 176 г ферум (ІІ) сульфіду з надлишком хлоридної кислоти. Розрахуйте масу жовтої твердої речовини, що утворилась у результаті реакції. 38. При взаємодії гідроген сульфіду із сульфур (IV) оксидом утворився осад масою 51,2 г. З’ясуйте, який об’єм гідроген сульфіду прореагував (н.у.)? Визначте об’єм розчину сульфатної кислоти (w=90%; r=1,825 г/см3), що витратиться на розчинення одержаного осаду. 39. Розрахуйте масу барій хлорид дигідрату та об’єм води, які необхідно використати для виготовлення розчину барій хлориду з масовою часткою солі 40%, необхідного для осадження всіх сульфат-іонів у розчині, одержаному при розчиненні 40 г сульфур (VI) оксиду в 200 г розчину сульфатної кислоти з масовою часткою кислоти 20%. 40. При взаємодії газу, який утворився при дії надлишку хлоридної кислоти на натрій гідрогенсульфіт, з іншим газом, який добули в результаті дії надлишку хлоридної кислоти на ферум (ІІ) сульфід, одержали осад масою 144 г. Розрахуйте маси солей, використаних для добування відповідних газів. 41. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення: S®H2S®SO2®SO3®KHSO4®K2SO4. 42. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення: S®K2S®MgS®Mg(HS)2®MgS®H2S. 43. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення: K2SO3®SO2®S®H2SO4®NaHSO4®Na2SO4. 44. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення: Fe®FeS®H2S®ZnS. ¯ ¯ SO2 ®S. 45. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення: гідроген сульфід®натрій сульфід®натрій гідрогенсульфід®натрій сульфід®купрум (ІІ) сульфід®сульфур (IV) оксид®барій сульфіт. 46. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення: цинк гідрогенсульфат®цин
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 572; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.202.60 (0.012 с.) |


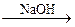 Б
Б

 Cu
Cu  A
A  В
В  Г
Г Д
Д цинк сульфат®цинк хлорид
цинк сульфат®цинк хлорид натрій тетрагідроксоцинкат
натрій тетрагідроксоцинкат Na2[Pb(OH)4]
Na2[Pb(OH)4] Pb(NO3)2
Pb(NO3)2  А
А
 Al ® Al2(SO4)3 ® Al(OH)
Al ® Al2(SO4)3 ® Al(OH) CaOCl2®Cl2
CaOCl2®Cl2 Cl2®HCl®Cl2
Cl2®HCl®Cl2 


