
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дослідження впливу концентрацій реагуючихСодержание книги
Поиск на нашем сайте РЕЧОВИН НА ШВИДКІСТЬ РЕАКЦІЇ НАТРІЙ ТІОСУЛЬФАТУ Й СУЛЬФАТНОЇ КИСЛОТИ Унаслідок взаємодії сульфатної кислоти з натрій тіосульфатом виділяється сірка у вигляді муті. Напишіть рівняння реакцій, що відбуваються. Час від початку реакції до появи перших слідів муті залежить від концентрацій реагуючих речовин. Три бюретки заповніть по черзі: першу – водою, другу – розчином натрій тіосульфату, третю – розчином сульфатної кислоти. У чотири пронумеровані пробірки налийте вказані в таблиці кількості розчину тіосульфату й води. В інші чотири пробірки відміряйте бюреткою по 4 мл розчину сульфатної кислоти. Налийте в першу пробірку відміряну кількість сульфатної кислоти, швидко перемішайте й визначте за секундоміром час від моменту злиття розчинів до появи муті в пробірці. Швидкість реакції визначте як величину, обернено пропорційну знайденому часові. Дані досліду запишіть у таблицю:
Аналогічно проведіть досліди з іншими пробірками. Залежність між зміною концентрації розчину й швидкістю реакції зобразьте графічно. На осі абсцис відкладіть величину концентрації розчину, на осі ординат – величину швидкості реакції. Визначте, яка лінія відповідає знайденій залежності.
ЛАБОРАТОРНА РОБОТА 5 ЗАГАЛЬНІ ВЛАСТИВОСТІ РОЗЧИНІВ
Визначення масової частки розчину за його відносною густиною Візьміть у лаборанта склянку з розчином, масову частку якого потрібно визначити. Ознайомтесь із ареометром і з’ясуйте ціну поділки. На око можна оцінити 1/3 малої поділки, тобто за допомогою ареометра можна визначити відносну густину з точністю до 0,003 г/см3. Налийте в циліндр приблизно 250 мл розчину (20°С) і обережно опустіть у нього ареометр. Зніміть і запишіть показання ареометра (слідкуйте, щоб під час досліду ареометр не торкався до стінок циліндра). Підніміть ареометр на 1-2 см, знов опустіть його в розчин і ще раз визначте його показання. Розчин вилийте у склянку. Ареометр помийте. Користуючись таблицею, знайдіть, яка масова частка відповідає знайденій густині розчину. Якщо в таблиці відсутнє знайдене значення густини, потрібно застосувати метод інтерполяції – встановлення проміжного значення величини за двома крайніми. Наприклад, для розчину калій нітрату відносна густина 1,083 у таблиці відсутня, але є значення величин – меншої (1,076) і більшої (1,090). Обчислюють різницю між значеннями та масовими частками розчинів:
1,090 – 14% 1,076 – 12%
0,014 – 2,0%
Знаходять різницю між величиною густини, визначеною ареометром, і меншою табличною: 1,083 – 1,076 = 0,007. Складають пропорцію: 0,014 – 2% 0,007 – х%
Знайдене число додають до меншої табличної величини масової частки 12% + 1% = 13% - воно відповідає концентрації досліджуваного розчину. Приготування розчину з наважки твердої речовини й води Приготуйте 250 (100) мл розчину з масовою часткою натрій сульфату 10% із кристалогідрату Na2SO4∙10H2O та води. Спочатку необхідно обчислити, скільки грамів кристалогідрату й мілілітрів води треба взяти для приготування розчину. Відповідну наважку кристалогідрату спочатку розчиніть у невеликій кількості води в склянці, а потім перелийте в мірну колбу на 250 (100) мл і додайте дистильованої води до позначки. Виміряйте за допомогою ареометра густину розчину й порівняйте з табличною величиною. Замість натрій сульфату можна приготувати розчини з масовими частками солей 10% виходячи з MgSO4∙7H2O (густина розчину 1,103 г/см3) або CuSO4∙5H2O (густина розчину 1,107 г/см3). Приготування розчину сульфатної кислоти із заданою масовою часткою з більш концентрованої сульфатної кислоти та води Виміряйте ареометром густину даної сульфатної кислоти. За таблицею визначте її масову частку. Обчисліть, яку кількість цієї кислоти потрібно взяти для приготування 100 мл розчину сульфатної кислоти з молярною концентрацією еквівалентів 0,2 моль/л. Мірну колбу заповніть приблизно до половини дистильованою водою і налийте в неї розрахований об’єм кислоти. Оскільки розчинення кислоти супроводжується виділенням тепла, охолодіть колбу під струменем проточної води до кімнатної температури. Долийте дистильованої води в колбу до мітки. Закрийте колбу пробкою і ретельно збовтайте її вміст.
ЛАБОРАТОРНА РОБОТА 6 РЕАКЦІЇ В РОЗЧИНАХ ЕЛЕКТРОЛІТІВ Зміщення рівноваги в напрямку утворення малодисоційованих І газоподібних речовин 1.До 1 мл розчину натрій ацетату додайте 1 мл розбавленої сульфатної кислоти. Зверніть увагу на появу запаху. 2.До 1 мл розчину амоній хлориду додайте такий же об’єм розчину натрій (калій) гідроксиду. Зверніть увагу на появу запаху. Вміст пробірки нагрійте й піднесіть до її отвору змочену рожеву лакмусову смужку. Прослідкуйте за реакцією. 3.До 1 мл розчину натрій карбонату додайте 1 мл розчину хлоридної кислоти. Прослідкуйте за результатом. 4.До 1 мл розчину натрій гідроксиду додайте 1-2 краплини метилоранжу, а потім по краплині підливайте розбавлений розчин хлоридної кислоти, доки не утвориться оранжево-жовте забарвлення. Повторіть дослід, змінивши розчин натрій гідроксиду на розчин аміаку.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 272; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

 .
.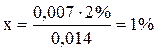 .
.


