
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тиск насиченої водяної пари при різних температурахСодержание книги
Поиск на нашем сайте
Запишіть дані досліду та результати розрахунків у таблицю:
ЛАБОРАТОРНА РОБОТА 2 ВИВЧЕННЯ КЛАСІВ НЕОРГАНІЧНИХ СПОЛУК
Запропоновані завдання розкривають та ілюструють теоретичні знання, розвивають навички хімічного експерименту. Кожному студенту дають окремий варіант завдання. Перш ніж виконувати експериментальну частину уважно прочитайте завдання та складіть детальний план роботи. Досліди проводьте в пробірках, реактиви додавайте обережно, кількома краплями. Кожен наступний етап роботи виконуйте після перенесення частини реакційної суміші в іншу пробірку. Для вивчення властивостей малорозчинних сполук після утворення осадів дайте суміші відстоятися, злийте обережно розчин і розділіть осад на декілька проб. Уважно спостерігайте та фіксуйте в лабораторному журналі ефекти, які супроводжують перебіг кож-ної реакції. Складіть рівняння цих реакцій у молекулярній та йонно-молекулярній формах. Варіант 1 1.Дослідним шляхом визначте за характерними реакціями та доведіть, у яких пробірках містяться розчини: натрій хлориду, натрій гідроксиду, хлоридної кислоти. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
Варіант 2 1.Дослідним шляхом визначте й доведіть, у яких пробірках містяться розчини: натрій хлориду, амоній хлориду, натрій карбонату. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення: мідь ® купрум (ІІ) оксид ® купрум (ІІ) хлорид ® купрум (ІІ) гідроксид ® купрум (ІІ) сульфат ® купрум (ІІ) хлорид ® аргентум хлорид. Варіант 3 1.Дослідним шляхом визначте та доведіть, у яких пробірках містяться розчини: ферум (ІІ) сульфату, алюміній сульфату, ферум (ІІІ) хлориду. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення: залізо ® ферум (ІІ) хлорид ® ферум (ІІ) гідроксид ® ферум (ІІІ) гідроксид® ферум (ІІІ) оксид ® ферум (ІІІ) сульфат ® ферум (ІІІ) хлорид. Варіант 4 1.Дослідним шляхом визначте та доведіть, у яких пробірках містяться кристалічні солі: натрій сульфат, натрій хлорид, натрій йодид. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
цинк®цинк хлорид®цинк гідроксид
Варіант 5 1.Дослідним шляхом визначте та доведіть, у яких пробірках містяться розчини солей: натрій сульфату, натрій сульфіду, натрій сульфіту. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
Pb ® Pb(NO3)2 ® Pb(OH)2
+Al ¯ Б Варіант 6 1.Дослідним шляхом визначте за характерними реакціями та доведіть, у яких пробірках містяться розчини: нітратної кислоти, натрій гідроксиду, сульфатної кислоти. Напишіть рівняння реакцій у молекулярній та іонній формах. 2.Здійсніть перетворення:
Na[Al(OH)4]
ЛАБОРАТОРНА РОБОТА 3 ВИЗНАЧЕННЯ КІЛЬКОСТІ ТЕПЛОТИ НЕЙТРАЛІЗАЦІЇ ЛУГУ СИЛЬНОЮ КИСЛОТОЮ
Досліди, пов’язані з експериментальним визначенням теплових ефектів хімічних процесів, проводять за допомогою калориметра, що складається з двох склянок (100 і 250 мл), вставлених одна в одну. Калориметр накривають кришкою з отворами для мішалки й термометра. Зважте внутрішню склянку калориметра. Налийте в неї мірною колбою 50 мл 1М розчину хлоридної кислоти. Помістіть склянку з кислотою в зовнішню склянку калориметра й виміряйте температуру кислоти з точністю до 0,05°С. У склянку місткістю 100 мл відміряйте 50 мл 1М розчину натрій гідроксиду і також визначте його температуру. Перемістіть розчин за допомогою лійки в калориметр, перемішуючи при цьому його вміст. Прослідкуйте, якою буде максимальна температура, на термометрі після злиття розчинів. Дані досліду запишіть у журнал у такій формі:
Обчисліть, яка кількість теплоти виділилася внаслідок реакції, за формулою: Q = (mрCр + mскCск)×Dt; Dt = tкінц. – tпоч., де tпоч. і tкінц. – початкова й кінцева температури в калориметричній склянці; mск і mр – маси склянки й рідини в ній відповідно; Сск і Ср – питомі теплоємності скла й рідини відповідно. У розрахунках припускається, що густина розчину дорівнює 1 г/см3; його питома теплоємність дорівнює теплоємності води, тобто 4,184 Дж/г×К; питома теплоємність скла – 0,753 Дж/г×К. Обчисліть теплоту нейтралізації з розрахунком на 1 моль кислоти. Визначте відносну похибку досліду, якщо відомо, що під час нейтралізації 1 моля сильної одноосновної кислоти лугом виділяється 57,36 кДж тепла.
ЛАБОРАТОРНА РОБОТА 4
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-08; просмотров: 267; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.183.131 (0.01 с.) |


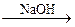 Б
Б

 Cu
Cu  A
A  В
В  Г
Г Д
Д цинк сульфат®цинк хлорид
цинк сульфат®цинк хлорид натрій тетрагідроксоцинкат
натрій тетрагідроксоцинкат Na2[Pb(OH)4]
Na2[Pb(OH)4] Pb(NO3)2
Pb(NO3)2  А
А
 Al ® Al2(SO4)3 ® Al(OH)
Al ® Al2(SO4)3 ® Al(OH)


