
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вплив температури на можливість перебігу хімічних процесівСодержание книги
Поиск на нашем сайте
Задача 8. Визначіть, при якій температурі реакція, представлена рівнянням C графіт + H2O(г) = CO(г) + H2(г) стає термодинамічно можливою. Зміни значень D H 0х.р та D S 0х.р зі зміною температури вважати незначними, тобто D H 0 Т х.р » D H 0298, х.р, D S 0 Т х.р » D S 0298, х.р. Розв’язання. Для цього виписуємо необхідні термодинамічні дані з довідника фізико-хімічних величин (додаток 2): D H 0298 (CO(г)) = -110,5 кДж/моль; D H 0298 (H2O(г)) = -241,8 кДж/моль; S 0298 (C графіт) = 5,7 Дж/(моль×К); S 0298 (H2O(г)) = 188,7 Дж/(моль×К); S 0298 (CO(г)) = 197,5 Дж/(моль×К); S 0298 (H2(г)) = 130,5 Дж/(моль×К). Розраховуємо зміну ентропії у процесі за стандартних умов (формула 9.2): D S 0х.р = S 0298 (CO(г)) + S 0298 (H2(г)) - S 0298 (H2O(г)) - S 0298 (C графіт); D S 0х.р = 130,5 + 197,5 - 188,7 - 5,7 = 133,6 Дж/К = 0,134 (кДж/К). Розраховуємо зміну ентальпії у процесі за стандартних умов (формула 9.1): D H 0 х .р = D H 0298 (CO(г)) + D H 0298(H2(г)) - D H 0298 (H2O(г)) - D H 0298 (C графіт); D H 0х.р = -110,5 + 0 - (-241,8) - 0 = 131,3 (кДж). Зміну енергії Гіббса у даній реакції за стандартних умов розраховуємо за формулою (9.3): D G 0х.р = D H 0х.р. - Т D S 0х.р; D G 0х.р = 131,3 - 298 × 0,134 = 91,37 (кДж). За стандартних умов цей процес є термодинамічно неможливим (оскільки D G 0х.р > 0), але він є оборотним (табл. 10.1): високі температури сприяють перебігу реакції у прямому напрямі. Визначаємо температуру, за якою реакція стає термодинамічно можливою: D G 0 Т х.р £ D H 0 Т х.р - Т D S 0 Т х.р; D G 0 Т х.р £ 0, тому D H 0 Т х.р - Т D S 0 Т х.р £ 0; Т ³ D H 0 Т х.р/D S 0 Т х.р; Т ³ 980 К. Отже, при температурі більше 980 К реакція буде проходити у прямому напрямі. Задача 9. Поясніть, за рахунок якого фактора - ентальпійного чи ентропійного - можливе проходження за стандартних умов екзотермічної реакції, представленої термохімічним рівнянням: 2Be(к) + O2(г) = 2BeO(к), D H 0х.р = -1197,4 кДж. Розв’язання. Проаналізуємо рівняння D G 0х.р = D H 0х.р - Т D S 0х.р. Дана хімічна реакція є екзотермічною, оскільки за умовою D H 0х.р < 0. Визначимо знак зміни стандартної ентропії в реакції, якщо вважаємо, що зміна ентропії головним чином залежить від зміни кількості молів тільки газоподібних речовин. Серед вихідних речовин 1 моль газу, а серед продуктів реакції - жодного. Тому за формулою D n х.р = (S nі) прод - (S nі) вих. зміна кількості молів газів у процесі дорівнює: D n х.р= 0 - 1 = -1(моль). Оскільки D n х.р < 0, невпорядкованість системи дещо зменшується, а тому ентропія також зменшується (отже, D S 0х.р < 0). Надалі потрібно пам’ятати, що абсолютна температура Т - величина завжди додатна. За умовою задачі ця реакція довільно відбувається за стандартних умов, тому зміна вільної енергії Гіббса D G 0х.р < 0. Це можливо тільки у разі, коли ½D H 0х.р½>½ Т D S 0х.р½, тобто ентальпійний фактор за абсолютною величиною перевищує ентропійний. Отже, за стандартних умов рушійною силою даної реакції є ентальпійний фактор.
ХІМІЧНА КІНЕТИКА І ХІМІЧНА РІВНОВАГА
Програмні питання Швидкість реакції, молекулярність і порядок реакції. Залежність швидкості реакції від концентрації реагуючих речовин, закон діючих мас. Константа швидкості реакції, її фізичний зміст. Особливості кінетики гетерогенних процесів. Залежність швидкості та константи швидкості хімічної реакції від температури. Правило Вант-Гоффа, температурний коефіцієнт швидкості реакції. Теорія та рівняння Арреніуса, енергія активації. Сучасні уявлення про механізм елементарного акту хімічної реакції. Теорія активних співударів, енергія активації у межах цієї теорії. Каталіз, каталізатори, інгібітори хімічних перетворень. Теорії перехідного стану та активованого комплексу. Особливості гетерогенного каталізу. Хімічна рівновага. Кінетична та термодинамічна умови рівноважного стану системи. Константа рівноваги, її фізичний зміст. Особливості виразу константи рівноваги гетерогенних процесів. Зв’язок між константою рівноваги і термодинамічними функціями. Вплив зовнішніх умов на зміщення стану хімічної рівноваги, принцип Ле Шательє.
Кінетика хімічних процесів
Хімічна кінетика досліджує швидкість хімічних реакцій та її залежність від різноманітних факторів. Знання матеріалу цього розділу дозволяє робити свідомий вибір оптимальних умов проведення виробничих процесів, інтенсифікувати їх та цілеспрямовано керувати ними. Критерієм принципової можливості самовільного проходження процесу є зменшення вільної енергії Гіббса (D G 0х.р < 0). Ця термодинамічна умова довільного перебігу хімічної реакції є необхідною, але не достатньою для кінетичного проходження реакції. Наприклад, оскільки значення стандартної енергії Гіббса утворення йодиду алюмінію від’ємне (D G 0298 (AlI3) = -313,8 кДж/моль), за стандартних умов термодинамічно можливою є реакція Al(к) + 3/2 I2 (к) = AlI3 (к), D H 0х.р = -308 кДж. Однак за стандартних умов дана реакція відбувається тільки за наявності води як каталізатора. Хімічний процес є результатом здійснення великої кількості елементарних актів взаємодії, які відбуваються під час зіткнення реагуючих між собою мікрочастинок (молекул, атомів, іонів, радикалів тощо). Однак не кожний такий співудар є результативним, тобто приводить до хімічної взаємодії. Щоб частинки взаємодіючих речовин прореагували, вони повинні не тільки мати надлишкову порівняно із середньою для даних молекул енергію, а й бути певним чином орієнтовані одна відносно одної. Мінімальну надлишкову енергію порівняно із середньою для даних молекул, яку повинні мати частинки, щоб прореагувати, називають енергією активації ЕА (кДж/моль). За теорією Арреніуса енергія активації - це енергія утворення 1 моль активної модифікації зі звичайних молекул; вона витрачається на послаблення та розрив зв’язків у молекулах реагуючих речовин. Кожна реакція має свій “енергетичний бар’єр” - свою енергію активації. Причому, чим менше значення енергії активації, тим швидше перебігає хімічний процес. Швидкість реакції визначають зміною концентрації вихідних речовин (або продуктів реакції) за одиницю часу. Вона залежить від багатьох факторів: від природи і агрегатних станів реагуючих речовин, їхніх концентрацій (або тисків), температури та наявності каталізаторів. Вплив концентрації (або кількості ефективних співударів в одиниці об’єму за одиницю часу) на швидкість реакції виражають за допомогою закону діючих мас. Для реакції aA + bB де всі речовини - гази, за сталих температури і тиску математичний вираз закону діючих мас має вигляд: v = k CAа CBb, (11.1) де v - швидкість реакції, моль/(л×с); k - коефіцієнт пропорційності - константа швидкості реакції; CА і СВ - молярні концентрації вихідних речовин, моль/л; a, b - стехіометричні коефіцієнти в рівнянні реакції. Звернемо увагу на фізичний зміст константи швидкості реакції: вона дорівнює швидкості реакції, якщо концентрації усіх реагуючих речовин дорівнюють 1 моль/л або добуток концентрацій реагуючих речовин дорівнює одиниці. Константа швидкості залежить від природи реагуючих речовин, температури та наявності каталізатора, але не залежить від концентрацій (або тисків) реагуючих речовин. Кожній реакції при сталій температурі відповідає певне значення константи швидкості. Гетерогенні реакції мають певні особливості, оскільки ці процеси відбу- ваються на поверхні поділу фаз у декілька стадій: 1) підведення реагуючих речовин до поверхні поділу фаз за рахунок процесу дифузії (процес самовільного вирівнювання концентрації речовини); 2) хімічне перетворення на поверхні поділу фаз; 3) відведення продуктів реакції від поверхні поділу фаз (також процес дифузії). Іноді перед другою стадією може відбуватися адсорбція на поверхні - процес самовільної зміни концентрації речовини біля поверхні поділу фаз. У такому разі після стадії хімічного перетворення відбувається процес десорбції продуктів реакції. Стадія, яка проходить найбільш уповільнено, є лімітуючою для даного хімічного процесу швидкість усього гетерогенного процесу. Швидкість гетерогенного процесу прямо пропорційна площі поверхні, на якій відбувається хімічна взаємодія, тобто поверхні поділу фаз. Оскільки молярні концентрації речовин у кристалічному стані у реакціях практично не змінюються, їх можна вважати сталими та врахувати у значенні константи швидкості. Наприклад, вираз швидкості гетерогенного процесу C(к) + 2Н2(г) = СН4(г) має вигляд: v = kC 2(H2). Підвищення температури, як правило, супроводжується збільшенням швидкості реакції, оскільки різко зростає кінетична енергія реагуючих частинок. Це, у свою чергу, приводить до збільшення частки активованих частинок і, як наслідок, до зростання константи швидкості реакції. Згідно з емпіричним правилом Вант-Гоффа, під час підвищення температури на кожні 10 °С швидкість хімічної реакції зростає приблизно в 2 - 4 рази, тобто температурний коефіцієнт швидкості g більшості реакцій лежить у межах 2…4. Температурний коефіцієнт швидкості реакції g показує, у скільки разів зростає швидкість хімічної реакції при підвищенні температури на кожні 10 °С. Великий науковий та практичний інтерес мають каталітичні реакції, оскільки у промисловості хімічні процеси найчастіше кінетично відбуваються тільки за наявності каталізаторів. Каталізатори - це речовини, які беруть участь у процесі, прискорюючи його, але наприкінці реакції залишаються незмінними. У свою чергу, інгібітори - це речовини, які уповільнюють проходження реакції (однак їх дія описується іншими механізмами); Причому. інгібітори витрачаються наприкінці реакції. Причина зміни швидкості реакції за наявності каталізатора полягає у проходженні процесу у декілька стадій. Якщо перебігає реакція А + В яка має достатньо високе значення енергії активації, то із введенням каталізатора за першою схемою гомогенного каталізу можливий перебіг таких процесів: 1) А + K 2) АK + В За другою схемою процес відбувається таким чином: А + В + K Швидкість процесу зростатиме, якщо зменшуються енергії активації кожної проміжної стадії порівняно з енергією активації первісної реакції, тобто ЕА 1 + ЕА 2 << ЕА. Отже, каталізатор спрямовує процес енергетично вигіднішим шляхом. Крім того, каталізатор однаковою мірою впливає на швидкості прямого і зворотного процесів оборотних реакцій, прискорюючи досягнення стану рівноваги, а тому не зміщує рівноважного стану. Рівноважні процеси
Процес називають оборотним, якщо за однакових умов можливий перебіг реакції і у прямому, і у зворотному напрямах. Термодинамічна умова хімічної рівноваги - це мінімальне значення вільної енергії Гіббса. Кінетична умова хімічної рівноваги досягається, якщо швидкість прямої та зворотної реакцій однакова: v пр = v зв. Кількісною характеристикою стану рівноваги, яка визначає повноту проходження процесу, є константа рівноваги K р, яка показує у скільки разів константа швидкості прямої реакції відрізняється від константи швидкості зворотної реакції. Константа рівноваги
де k пр - константа швидкості прямого процесу; k зв - константа швидкості зворотного процесу. Фізичний зміст константи хімічної рівноваги легко зрозуміти. Якщо k пр > k зв, то K р > 1, тобто реакція перебігає необоротно у прямому напрямку до кінця. Якщо k пр < k зв, то K р < 1, тобто реакція проходить необоротно у зворотному напрямку. Константа рівноваги залежить від природи та агрегатного стану реагуючих речовин, температури і не залежить від концентрацій (або тисків) реагуючих речовин, наявності каталізатора. Для гетерогенного процесу запис виразу константи рівноваги має певні особливості: він містить тільки концентрації рідких (якщо реакція відбувається у розчині) або газоподібних речовин, якщо реакція відбувається у газовій фазі (або парціальні тиски газів). Концентрації твердих речовин у гетерогенних процесах вважають сталими, а тому не вводять до виразу константи рівноваги процесу. Хімічна рівновага має динамічний характер і залежить від параметрів стану системи (концентрації, тиску, температури тощо). Зі зміною хоча б одного з параметрів стану системи рівновага в системі порушується, причому в системі відбуватимуться процеси, які сприяють послабленню впливу даного фактора. У такому випадку одна з реакцій (пряма або зворотна) перебігає з більшою швидкістю, поки не встановиться інший стан рівноваги вже за нових рівноважних концентрацій. Цей процес називають зміщенням хімічної рівноваги. Напрям зміщення стану хімічної рівноваги можна визначити за допомогою принципу Ле Шательє (принципу протидії): “Зміна будь-якого параметра стану рівноважної системи збільшує швидкість тієї реакції, яка протидіє цій зміні”. Цей принцип використовують для цілеспрямованого зміщення стану рівноваги у напрямі максимального виходу потрібного продукту реакції, для оптимізації промислових процесів, під час проведення наукових досліджень і вирішення більшості екологічних проблем.
11.3. Запитання для самостійної підготовки 1. Що називають швидкістю хімічної реакції? Як її можна визначити? 2. Які основні фактори та як саме вони впливають на швидкість хімічної реакції (гомогенної, гетерогенної)? Назвіть умови результативних зіткнень. 3. Сформулюйте і запишіть математичний вираз закону діючих мас. Який фізичний зміст константи швидкості хімічної реакції? Від яких факторів вона залежить? 4. Через які стадії проходить гетерогенний процес? У чому полягають особливості виразу закону діючих мас для гетерогенних реакцій? Відповідь обґрунтуйте, наведіть приклади. 5. Чому швидкість реакції сильно зростає під час підвищення темпе-ратури? Як можна визначити температурний коефіцієнт швидкості хімічної реакції, який у нього фізичний зміст? 6. У чому суть теорії хімічної взаємодії Арреніуса? Що таке енергія активації ЕА за теорією Арреніуса, від яких факторів вона залежить? Як впливає величина ЕА на швидкість хімічної реакції? 7. Як можна знайти енергію активації реакції? Яке сучасне визначення енергії активації? 8. Що таке каталіз, каталізатор, інгібітор? Як впливає каталізатор на швидкість хімічної реакції та на зміну енергії активації процесу? 9. Які реакції називають оборотними? Як характеризують стан хімічної рівноваги з погляду термодинаміки, кінетики? 10. Який фізичний зміст константи рівноваги хімічної реакції? Від яких факторів вона залежить? Навести приклади виразів констант рівноваги для гомогенних і гетерогенних процесів. 11. Як зв’язані константа рівноваги процесу і зміна вільної енергії Гіббса? 12. Сформулюйте принцип Ле Шательє. Як можна передбачити вплив температури на зміщення стану хімічної рівноваги? Поясніть на прикладах. 13. Як можна змістити хімічну рівновагу при сталій температурі? Як впливає тиск, концентрації вихідних речовин і продуктів реакції на рівно-важний вихід? 14. Чому введення каталізатора не зміщує стан рівноваги?
12.Приклади розв’язання типових задач з теми 11 Задача 1. Запишіть математичні вирази швидкостей прямого та зворотного процесів: 2СО(г) + О2(г) Як зміниться швидкість прямої реакції, якщо тиск у системі збільшити у 3 рази? Розв’язання. Згідно із законом діючих мас (формула (11.1)), вираз швид-кості прямої реакції має вигляд v пр = k пр С 2(СО) С (О2), де k пр - константа швидкості прямої реакції. Швидкість зворотної реакції v зв= k зв С 2(СО2), де k зв - константа швидкості зворотної реакції. Позначимо концентрації вихідних речовин до зміни тиску в системі: С (СО) = а; С (О2) = b. Тоді v пр = k пр а2b. Згідно з рівнянням Менделєєва - Клапейрона pV = nRT, (11.2) де n = C (Х) V - кількість молів газу; С (Х) - молярна концентрація, моль/л; R - універсальна газова стала (R = 8,31Дж/(моль·К)). Підвищення тиску приводить до пропорційного збільшення концентрації кожного з газоподібних компонентів. Таким чином, після підвищення тиску в системі концентрація вихідних речовин становитиме: С ΄(СО) = 3 а; С ΄(О2) = 3 b. Тоді швидкість прямої реакції v ΄пр = k пр (3 а)2 3 b = 27 k пр а 2 b;
Отже, з підвищенням тиску у три рази швидкість прямої реакції збільшиться у 27 разів. Задача 2. У скільки разів і як зміняться швидкості прямої та зворотної реакцій у системі 2SO2(г) + O2(г) якщо об’єм газової суміші збільшити у п’ять разів? У який бік зміститься рівновага у системі? Розв’язання. Позначимо тиск газоподібних речовин до зміни об’єму системи: р (SO2) = a; р (О2) = b; р (SO3) = d. Тоді згідно із законом діючих мас (формула (11.1)), швидкості прямої та зворотної реакцій становлять: v пр = k пр а 2 b; v зв = k зв d 2. Після збільшення об’єму гомогенної системи у п’ять разів тиск кожної з газоподібних речовин зменшиться теж у п’ять разів (формула (11.2)), тобто р ΄(SO2) = (1/5) a; р ΄(О2) = (1/5) b; р ΄(SO3) = (1/5) d. Тоді швидкості прямої та зворотної реакцій становитиме v ¢пр = k пр v ¢зв = k зв Звідси
Отже, швидкість прямої реакції зменшиться у 125 разів, а зворотної - тільки в 25 разів. При цьому рівновага у системі зміститься у бік зворотної реакції. Задача 3. Обчисліть, у скільки разів збільшиться швидкість гомогенної реакції, яка проходить у газовій фазі, якщо температура зросте від 30 до 70 °С, якщо температурний коефіцієнт швидкості реакції дорівнює двом. Розв’язання. Математичний вираз правила Вант-Гоффа має вигляд
де g - температурний коефіцієнт швидкості реакції. Якщо темпepатура змінюється на (n 10)°, то
Швидкість реaкції зростатиме зі збільшенням температури у стільки разів, у скільки зросте константа швидкості даної реакції. Для цієї реакції (враховуючи, що D Т = D t):

Отже, з підвищенням температури на 40 °С швидкість даної реакції збільшиться у 16 разів. Задача 4. Для деякої хімічної реакції константи швидкості при температурах 298 і 338 К дорівнюють k 298 = 0,01 і k 338 = 0,4 відповідно. Обчисліть температурний коефіцієнт швидкості реакції, константу швидкості при температурі 310 К та енергію активації цієї реакції. Розв’язання. Температурний коефіцієнтшвидкості реакції g можна визначити за формулою (11.3) після логарифмування:
Визначаємо константу швидкості реакції при температурі 310 К (Т 3):
За значеннями констант швидкості реакції при будь-яких двох температурах можна розрахувати енергію активації ЕА реакції за рівнянням Арреніуса:
Задача 5. Обчисліть, у скільки разів зменшиться швидкість деякої реакції під час зниження температури від 373 до 323 К, якщо енергія активації реакції становить 125,61 кДж/моль. Розв’язання. Залежність константи швидкості реакції від температури описують формулою (11.4):
Отже, зі зниженням температури з 373 до 323 К швидкість реакції зменшиться у 534 рази. Задача 6. З підвищенням температури з 298 до 398 К швидкість гетеро-генного процесу збільшилась у 25 000 разів. Обчисліть енергію активації реакції та визначіть, яка стадія процесу є лімітуючою: кінетична чи дифузійна. Розв’язання. З рівняння Арреніуса (формула (11.5))
Відомо, що для кінетичних процесів (лімітуючою стадією є хімічна взаємодія) g лежить у межах 2…4, а EA = 50…200 кДж/моль; тоді як для дифузійних процесів g = 1,1…1,4, а EA = 5…20 кДж/моль. Обчислене значення енергії активації вказує на те, що лімітуючою стадією даного гетерогенного процесу є хімічна взаємодія. Задача 7. Константа рівноваги реакції, поданої рівнянням: CO(г) + H2O(г) при 850 °С дорівнює одиниці (K р = 1). Визначіть рівноважні концентрації усіх речовин, якщо вихідні концентрації реагуючих речовин становлять С вих(СО) = 3 моль/л; С вих(Н2О) = 2 моль/л. Розв’язання. Узагальномувиглядідляреакції aA + bB де всі речовини - гази, математичний вираз константи рівноваги має вигляд:
де [ А ], [ В ], [ Е ], [ D ] - рівноважні молярні концентрації речовин, моль/л. Запишемо закон діючих мас для прямої та зворотної реакцій: v пр = k пр С (СО) С (Н2О); v зв = k зв С (СО2) С (Н2). У стані рівноваги v пр = v зв. Для даної реакції математичний вираз константи рівноваги має вигляд:
Припустимо, що у стані рівноваги концентрація вуглекислого газу СО2 становила х моль/л. Згідно з рівнянням реакції, концентрація водню Н2 буде також х моль/л. На утворення х молів СО2 і х молів Н2 витрачають таку саму кількість молів (на 1 літр) СО і Н2О. Отже, рівноважні концентрації усіх речовин становитимуть [CO2] = [H2] = х моль/л;[CO] = 3 - х моль/л; [H2O] = 2 - х моль/л. Тоді
x 2 = 6 - 2 x - 3 x + x 2; x = 1,2 (моль/л). Таким чином, [CO2] = [H2] = 1,2 моль/л;[CO] = 3 - 1,2 = 1,8 моль/л; [H2O] = 2 - 1,2 = 0,8 моль/л. Задача 8. Запишіть математичний вираз та розрахуйте значення кон-станти рівноваги реакції, поданої рівнянням: FeO(к) + CO(г) якщо рівноважні молярні концентрації речовин становлять: [CO2] = 0,05 моль/л; [CO] = 0,1 моль/л. Розв’язання. Дана реакція - гетерогенна. Оскільки вона відбувається на поверхні поділу фаз, яка практично не змінюється у процесі, площу поверхні та концентрації твердих речовин можна вважати сталими. Тому у вираз константи рівноваги вводимо тільки рівноважні концентрації газів: K р = Задача 9. Обчисліть константу рівноваги реакції, поданої рівнянням: Н2(г) + I2(г) якщо D G 0298(HI) = 1,3 кДж/моль. Розв’язання. Для даної реакції константа рівноваги має вигляд:
Вільну енергію Гіббса та константу рівноваги процесу зв’язує співвідношення D G 0х.р = - RT ln K р = -2,3 RT lg K р, де D G 0х.р - зміна вільної енергії Гіббса в хімічному процесі за стандартних умов, кДж.
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 763; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.187.232 (0.009 с.) |

 eE + dD,
eE + dD,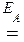 C + D,
C + D, АK;
АK; С + D + K.
С + D + K. ,
, .
.
 b =
b =  k пр а 2 b;
k пр а 2 b; =
=  k зв d 2.
k зв d 2.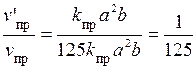 ;
; .
. g = 2…4,
g = 2…4,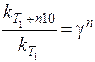 або
або  . (11.3)
. (11.3) 

 ; g = 2,51.
; g = 2,51.

 = 10-1,52 = 0,03.
= 10-1,52 = 0,03. ; (11.4)
; (11.4)
 (11.5)
(11.5)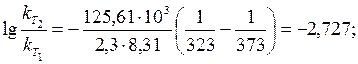
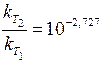
 .
.
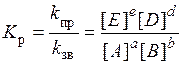 ,
, .
.
 =
= 
 .
.


