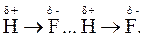Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Іонний та металічний хімічні зв’язки.Содержание книги
Поиск на нашем сайте
Міжмолекулярна взаємодія
Іонний зв’язок - це граничний випадок ковалентного полярного зв’язку. Він утворюється, наприклад, між атомами активних металів і атомами типових неметалів, тобто між елементами, електронегативності яких дуже сильно різняться. Оскільки при утворенні хімічного зв’язку спільні електрони не можуть повністю переходити до більш електронегативного елемента, а тільки зміщуються до нього, на атомах виникають нецілочислові ефективні заряди (d+ або d−). Зі зменшенням різниці електронегативностей DЕН атомів хімічних елементів частка іонного зв’язку зазвичай зменшується, а ковалентного, навпаки, - збільшується. Вважають, що при DЕН Початок теорії іонного зв’язку запровадив В. Коссель (1916 р.). Основні положення теорії іонного зв’язку: · Під час іонного зв’язку один з двох взаємодіючих атомів віддає електрон і перетворюється на позитивно заряджений іон (катіон), другий атом приєднує електрон і перетворюється на негативно заряджений іон (аніон). · Іони, що мають протилежні заряди, електростатично притягуються один до одного й утворюють хімічну сполуку з іонним зв’язком. Утворення іонної сполуки є енергетично вигідним процесом, якщо коли атом, що перетворюється на катіон, має низьку енергію іонізації, а атом, що стає аніоном, – високу енергію спорідненості до електрона. Оскільки між іонами діють електростатичні сили взаємодії, іонний зв’язок є ненапрямленим і ненасиченим. Ненапрямленість іонного зв’язку зумовлена тим, що електричне поле кожного іона поширюється у просторі рівномірно в усіх напрямках. Ненасиченість іонного зв’язку виявляється в тому, що під час взаємодії двох протилежно заряджених іонів їх електричні поля скомпенсовані неповністю, тому в них є принципова можливість взаємодії цих іонів з іншими. У результаті навколо кожного з іонів розташовані іони протилежного заряду. Сполуки з іонним зв’язком у вигляді молекул не існують ані в твердому стані, ані в розчині. Нестійкі молекули іонних сполук (наприклад, NaCl) можна виявити тільки в газоподібному стані при високих температурах.
Більшість хімічних елементів у вільному стані - метали. Для них характерні порівняно низькі енергії іонізації атомів, а для відповідних простих речовин - блиск поверхні, високі електро- і теплопровідність, пластичність, ковкість та ін. Висока тепло- та електропровідність металів зумовлені наявністю в їх кристалах вільних електронів, які рухаються по всьому кристалу. Такий тип зв’язку не можна віднести до іонного або ковалентного. Вважається, що в кристалах металів реалізується особливий металічний хімічний зв’язок. В атомах металів зазвичай мала кількість валентних електронів, але наявні вакантні (вільні) атомні орбіталі. Крім того, у металічному кристалі атоми розміщені дуже щільно. Через невисокі значення енергій іонізації, характерних для металів, електрони здатні легко відриватися від атомів та можуть переходити з однієї атомної орбіталі на іншу, тобто рухатися у всьому об’ємі кристала. Саме цим пояснюються високі електро- та теплопровідність металів. Можна сказати, що природа металічного зв’язку подібна до ковалентного: також відбувається узагальнення валентних електронів, але металічний зв’язок є делокалізованим і ненапрямленим. Докладніше характерні для металів властивості обґрунтовують за допомогою зонної теорії твердого тіла. Міжмолекулярні,або вандерваальсові сили (сили Ван-дер-Ваальса) мають електричну природу (тобто підкоряються закону Кулона). Вони діють на більших відстанях, ніж сили хімічного зв’язку, є досить слабкими, оскільки їх енергія набагато менша. Ці сили виникають унаслідок електрохімічного притягання різнойменно заряджених частин сусідніх молекул. Вони зазвичай зумовлюють фізичні властивості (або фізичні взаємодії) речовин. Завдяки міжмолекулярній взаємодії, наприклад, можливий перехід газоподібних речовин у рідкі та кристалічні стани (конденсований стан речовини). Виділяють наступні основні види міжмолекулярної взаємодії: орієнтаційна, індукційна, дисперсійна та водневий зв’язок. Орієнтаційна взаємодія зазвичай реалізується між двома або більше диполями. Індукційна взаємодія реалізується між диполями і неполярними молекулами, унаслідок чого неполярні молекули дещо поляризуються і набувають індукованих дипольних моментів. Індуковані диполі, у свою чергу, взаємодіють з полярними молекулами подібно до орієнтаційної взаємодії, але енергія індукційної взаємодії менша за енергію орієнтаційної взаємодії.
Речовини, які утворені неполярними молекулами (наприклад Н2, Cl2, O2, He, Ne та ін.), під час охолодження можуть переходити в рідкий і, навіть, у твердий стани. Це вказує на наявність міжмолекулярної взаємодії, хоча орієнтаційної взаємодії чи індукційного впливу в них не відбувається. У цих випадках міжмолекулярна взаємодія зумовлена одночасною (синхронною) появою у неполярних молекулах миттєвих диполів. Між ними й виникають сили притягання, які називають дисперсійними (дисперсійна взаємодія). Дисперсійна взаємодія універсальна: вона виникає між будь-якими молекулами незалежно від їх будови, а її енергія зазвичай суттєво менша за енергії орієнтаційної та індукційної взаємодій. Водневий зв’язок - особливий тип міжмолекулярної взаємодії, який може утворюватись між певними (функціональними) групами у складних молекулах. Він виникає між молекулами, до складу яких входить атом Гідрогену, зв’язаний із сильно електронегативним атомом, наприклад, O, F, Cl, N, S та ін. Природа водневого зв’язку електростатична та частково донорно-акцепторна, оскільки відбувається взаємодія між позитивно поляризованим атомом Гідрогену однієї молекули (акцептор) і негативно поляризованим атомом більш електронегативного елемента іншої молекули (донор). Наприклад, утворення димеру (H-F)2 обумовлено саме водневим зв’язком: Такий вид зв’язку характеризується просторовою напрямленістю та насиченістю. Енергія водневого зв’язку приблизно на порядок нижча за енергію хімічного зв’язку, але в декілька разів більша за енергію вже розглянутих міжмолекулярних взаємодій. Цей тип зв’язку суттєво впливає на фізичні властивості речовин. Зокрема, високі температури плавлення та кипіння таких речовин як H2O, HF, NH3 обумовлені утворенням їх асоціатів: (H2O)n; (HF)2 тощо. Як уже зазначалось, водневий зв’язок, характерний для молекул води і зумовлює деякі з так званих аномальних властивостей. У молекулі води два атоми Гідрогену сполучені із сильно електронегативним атомом Оксигену, тоді як дві неподілені електронні пари атома Оксигену здатні утворювати ще два водневі зв’язки із сусідніми молекулами. Це зумовлює тетраедричне розміщення у просторі двох ковалентних і двох водневих зв’язків відносно атома Оксигену, розміщеного в центрі тетраедра.
Кристалічний стан речовини Залежно від відстані між частинками та енергій їх взаємодії речовини можуть існувати в газоподібному, рідкому або твердому станах. Твердий і рідкий стани, як уже зазначалось, називають конденсованим станом. Твердий стан речовини характеризується тим, що між’ядерні відстані наближаються до розмірів частинок, а середня потенціальна енергія притягання між ними значно перевищує їх середню кінетичну енергію. Тверді речовини можуть існувати в кристалічному або аморфному станах. Кристалічні речовини мають упорядковану просторову структуру, у якій частинки (атоми, молекули, іони) досить регулярно чергуються у просторі. Розміщення частинок у кристалі можна зобразити за допомогою кристалічної решітки в її вузлах (точках перетину умовних прямих ліній, що утворюють просторовий каркас) розміщені ядра частинок, які складають кристал.
Фізико-хімічні властивості речовин у кристалічному стані залежать від типу зв’язку між частинками, які знаходяться у вузлах кристалічної решітки. За характером взаємодії між ними розрізняють: атомну, іонну, молекулярну та металічну кристалічні решітки. У вузлах атомної решітки знаходяться окремі атоми, зв’язані міцними ковалентними зв’язками (полярними чи неполярними). Речовини з атомною решіткою мають високі твердість та міцність. Вони нелеткі, мають високі температури плавлення, практично нерозчинні у жодному з розчинників, не проводять електричний струм. До таких речовин належать алмаз, кремній, германій, бор, а також багато бінарних сполук: B2O3, SiO2, Al2O3, BN, AlN, Si3N4, B4C3, SiC та інші. Речовини з молекулярним типом кристалічної решітки побудовані з молекул,
зв’язаних силами Ван-дер-Ваальса. Такі речовини легкоплавкі, леткі, не проводять електричного струму. Їхні властивості можуть змінюватися в широких межах залежно від полярності молекул, які містяться у вузлах решітки, а також від наявності і відсутності водневого зв’язку. Молекулярну кристалічну решітку мають речовини, які за звичайних умов є рідинами або газами (наприклад, кристалічні водень, кисень, галогени, інертні гази, вуглекислий газ, вода, більшість органічних сполук та ін.). Сполуки, в яких реалізується іонний зв’язок, а у вузлах знаходяться протилежно заряджені іони, мають іонну кристалічну решітку. Такі речовини характеризуються досить високими температурами плавлення і кипіння, значною твердістю. Іонні решітки міцніші за молекулярні, проте слабкіші за атомні. Розчиняючись у полярних розчинниках (наприклад, у воді), речовини з іонною кристалічною решіткою дисоціюють на іони, тому їх розчини проводять електричний струм. Іонну решітку мають, наприклад, солі, сильні мінеральні кислоти, луги тощо. Металічна кристалічна решітка поширена для металів, сплавів і деяких бінарних сполук металів з неметалами. У вузлах решітки знаходяться катіони й атоми металів, зв’язок між якими здійснюється електронами, що належать усьому кристалу. Для таких речовин характерні високі електро- і теплопровідності, металічний блиск, пластичність, ковкість. Реальні кристали найчастіше мають змішані типи решіток, наприклад, кристалічна решітка графіту складається з атомів вуглецю, зв’язаних ковалентним і частково металічним зв’язками. Саме тому він тугоплавкий, нелеткий та проводить електричний струм. М’якість графіту зумовлена пошаровою будовою кристалічної решітки.
7.5. Запитання для самостійної підготовки 1. У чому полягає причина утворення хімічного зв’язку? Яка його природа? 2. Який хімічний зв’язок називають ковалентним? Чим можна пояснити напрямленість і насиченість ковалентного зв’язку? 3. Як за допомогою методу валентних зв’язків (МВЗ) можна обґрунтувати утворення ковалентного зв’язку? 4. Який ковалентний зв’язок називають полярним? Що є кількісною мірою полярності зв’язку? Що таке поляризованість зв’язку? 5. Який механізм утворення хімічного зв’язку називають донорно-акцепторним? Чим він відрізняється від обмінного механізму? 6. Що таке кратність хімічного зв’язку? У чому відмінність між s- та p-зв’язками? 7. Що розуміють під гібридизацією атомних орбіталей? Орбіталі якого типу підлягають гібридизації під час утворення молекул: CH3Cl, AlH3, CaCl2? 8. Чому під час утворення молекули SnCl4 відбувається гібридизація атомних орбіталей центрального атома, а під час утворення молекули SnCl2 - ні? Обґрунтуйте геометричні форми молекул. 9. Який хімічний зв’язок називають іонним? Які властивості йонного зв’язку відрізняють його від ковалентного? 10. Що таке електронегативність ЕН? Як можна оцінити частку йонного зв’язку в молекулі за допомогою величин ЕН взаємодіючих атомів? 11. Що таке диполь? Що називають дипольним моментом молекули? Яка з наведених молекул - HCl, HBr або HІ - і чому має найбільше значення дипольного моменту? 12. Які молекули називають полярними? Чи може неполярна молекула мати полярні ковалентні зв’язки між атомами? Наведіть приклади. 13. Що називають міжмолекулярною взаємодією? Які взаємодії належать до орієнтаційних, індукційних та дисперсійних? 14. Який хімічний зв’язок називають водневим? Як впливає наявність водневого зв’язку на фізичні властивості речовин? Наведіть приклади. 15. Поясніть залежність фізичних властивостей речовин у кристалічному стані від типу зв’язку між частинками в кристалах. Наведіть приклади. 16. Що називається аморфним станом речовини? Чим він відрізняється від кристалічного? 17. Що називають ступенем окиснення та як його визначають? Наведіть приклади. 18. Чим відрізняються поняття валентності та ступеня окиснення? Наведіть приклади сполук, у яких ступінь окиснення елемента відрізняється від його валентності. 19. Наведіть приклади речовин, у кристалах яких реалізується металічний зв’язок. Чому метали мають високі тепло- та електропровідність? 20. Які фізичні властивості характерні для речовин з а) атомною; б) іонною; в) молекулярною і г) металічною кристалічними решітками?
|
||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 672; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.118.104 (0.011 с.) |

 1,8 (за іншими джерелами, при DЕН
1,8 (за іншими джерелами, при DЕН