
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Електролітична дисоціація води.Содержание книги
Поиск на нашем сайте
Водневий показник рН
Вода є досить слабким електролітом. Спрощена схема дисоціації молекул води, якою часто користуються, має вигляд: Н2О Іон гідрогену Н+ не може окремо існувати у водному розчині, оскільки він сильно гідратований – взаємодіє з молекулами води з утворенням іонів гідроксонію Н3О+. Тому рівняння дисоціації води можна записати таким чином: 2Н2О Тоді вираз для константи дисоціації води має вигляд:
Причому, у чисельнику – добуток рівноважних концентрацій іонів, а у знаменнику – рівноважна концентрація води. Оскільки вода дисоціює досить погано, вважають, що її рівноважна концентрація [H2O] практично не відрізняється від початкової молярної концентрації C(H2O), яку можна визначити таким чином:
Отже, C (H2O)» [H2O] = 55,56 моль/л. Кондуктометрично (методом вимірювання електропровідності) було визначено ступінь дисоціації води при 298,15 К ( Тоді константа дисоціації води при 298,15 К
а йонний добуток води (константа автоіонізації води) при 298,15 К:
Отже,
Згідно з формулою (15.4), у чистій воді чи в будь-якому водному розчині при постійній температурі добуток концентрацій іонів гідрогену Н+ та гідроксильних іонів ОН- є сталою величиною, яку називають іонним добутком води. Знаючи [ОН-] = [Н+] = Зазначимо, що процес дисоціації води є ендотермічним, тобто відбувається з поглинанням теплоти (D H 0дис = 57,3 кДж/моль). Іонний добуток води (константа автоіонізації води) залежить від температури: з підвищенням температури він трохи збільшується. Однак при температурах, близьких до кімнатної, можна вважати У нейтральному середовищі концентрації іонів Н+ і ОН- однакові, тобто [Н+] = [ОН-] = 10-7 моль/л. У кислих розчинах [Н+] > [ОН-], тоді як у лужних [Н+] < [ОН-]. Тому кислотність та лужність розчину кількісно можна характеризувати концентрацією одного з цих іонів. Для характеристики кислотності середовища датський біохімік С. Серен-сен (1909 р.) запропонував використовувати водневий показник рН, який дорівнює десятковому логарифму концентрації іонів гідрогену, взятому з протилежним знаком:
рН = -lg[H+] (15.7) Тоді [Н+] = 10-рН. (15.8) Аналогічно гідроксильний показник рОН визначають за формулою, рОН = -lg[ОH-]; (15.9) [ОН-] = 10-рОН (15.10) Для розбавлених розчинів при температурі близько 20…25 °С виконується умова: рН + рОН = 14. (15.11) Для точних вимірювань рН розчинів зазвичай використовують рН-метри.
Добуток розчинності
Поганорозчинні (малорозчинні) солі, наприклад, AgCl, AgBr, AgI, BaSO4 та інші, незначно розчиняючись у воді, утворюють насичені розчини над осадами. У таких системах між насиченим розчином і осадом встановлюється динамічна рівновага. Внаслідок малої концентрації розчиненого електроліту він практично повністю дисоційований на йони, а тому добуток концентрацій його іонів у насиченому розчині при певній температурі залишатиметься сталим. Наприклад, у насиченому розчині аргентуму хлориду АgCl має місце рівновага: AgCl Відповідно до закону діючих мас, константа рівноваги (константа дисоціації АgCl) має вигляд:
Оскільки концентрація твердої фази не змінюється ([AgCl(Т)] = const), її можна перенести у ліву частину рівняння до константи дисоціації: K Д[AgCl(т)]. = [Ag+][Cl-]. За сталої температури крім концентрації твердої фази сталою є ще і константа дисоціації,.тому є сталим і їх добуток. Добуток концентрацій іонів малорозчинного електроліту, які насичують розчин над осадом (тобто над твердою фазою) при сталій (а частіше – стандартній) температурі називають добутком розчинності електроліту (ДР). Зокрема, добуток розчинності ДР(AgCl) = 1,73 × 10-10. У загальному випадку для електроліту KtnAnm др визначають так: ДР(KtnAnm) = [ Kt m + ] n [ An n-] m, (15.12) де Kt - катіон електроліту; An - аніон електроліту; m+ - заряд катіона; n - заряд аніона; n і m - кількості катіонів і аніонів, відповідно, у молекулі електроліту. Це значення характеризує розчинність електроліту при сталій температурі, за умови, якщо немає сторонніх речовин у розчині. Отже, на основі значень добутків розчинності можна прогнозувати утворення і розчинення осадів електролітів. Розглянемо декілька типових випадків: 1. Електроліт випадає в осад, якщо добуток концентрацій його іонів у розчині (з урахуванням стехіометричних коефіцієнтів) більше добутку розчинності:
С (Kt m + ) n С (An n -) m > ДР(KtnAnm) . 2. Осад електроліту розчиняється, якщо добуток концентрацій його іонів у розчині (з урахуванням стехіометричних коефіцієнтів) стає меншим за добуток розчинності: С (Kt m + ) n С (An n -) m < ДР(KtnAnm) . Однак робити конкретні висновки щодо розчинності електролітів у певному середовищі можна тільки для однотипних електролітів (наприклад, Cu(OH)2 та Ni(OH)2 або СаСО3 та ВаСО3 та ін.). Розглянемо добутки розчинності для солей AgCl, AgBr, AgI та визначимо, яка з цих солей краще розчиняється у воді: ДР(AgCl) = 1,73 × 10-10; ДР(AgBr) = 5 × 10-13; ДР(AgІ) = 8,1 × 10-17. Отже, з цих даних видно, що найкраще у воді розчиняється арґентуму хлорид AgCl. Знаючи добуток розчинності, можна знайти концентрації іонів у насиченому розчині електроліту. Наприклад: ДР(AgCl) = [Ag+][Cl-] = 1,73 × 10-10. Тоді [Ag+] = [Cl-] = 1,315 × 10-5 моль/л.
Гідроліз солей Гідроліз єокремим випадком процесу сольволізу – взаємодії розчиненої речовини та розчинника. Гідролізом солей називають обмінний процес взаємодії солі з водою, внас-лідок чого утворюються малорозчинні слабодисоційовані речовини або гази. Можна зауважити, що гідроліз є процесом, оборотним реакції нейтралізації, тобто ендотермічним процесом. Залежно від природи солі, що підлягає гідролізу, розрізняють декілька його типових випадків: 1. Сіль утворена сильною кислотою і сильною основою, наприклад: NaCl + HOН Na+ + Cl- + HOН HOН Отже, за звичайних умов гідролізу практично не підлягають солі, утворені сильними кислотами і сильними основами, а також солі, нерозчинні у воді. 2. Сіль утворена слабкою основою і сильною кислотою:
 NH4OH + HCl; NH4OH + HCl;
NH4+ + Cl- + HOН NH4+ + HOН Гідроліз солі відбувається “ за катіоном”. Оскільки при гідролізі солі утворюється надлишок катіонів Н+, реакція середовища кисла, тобто рН < 7. Отже, реакцію середовища в результаті гідролізу можна визначити за сильнішим електролітом. Процес гідролізу відбувається таким чином: NH4Cl - сильний електроліт, який у водному розчині повністю дисоційований на іони:
У свою чергу, йони NH4+ та Cl- у воді гідратовані; тому гідролізу підлягає вже гідратований катіон амонію:
  NH4OH + Н+. NH4OH + Н+.
Якщо сіль утворена багатокислотною основою, гідроліз солі відбувається ступіньчасто, зокрема: Cu(NO3)2 + HOH Cu2+ + 2NO3- + HOH
І ступінь: Cu2+ + HOH ІІ ступінь: CuОН+ + HOH Як правило, гідроліз солей відбувається тільки за першим ступенем. 3. Сіль утворена сильною основою та слабкою кислотою:
СН3СОО- + НОН Гідроліз даної солі відбувається “ за аніоном”. Оскільки внаслідок гідролізу утворюється надлишок ОН-, то реакція середовища лужна (рН > 7). Якщо сіль утворена багатоосновною кислотою, процес гідролізу солі відбуватиметься ступіньчасто, наприклад:
У молекулярному вигляді: Na2CO3 + HOH
NaHCO3 + НOH Отже, якщо гідроліз такої солі відбувається тільки за першим ступенем, як продукти гідролізу утворюються кислі солі (NaHCO3 та ін.). 4. Сіль утворена слабкою основою і слабкою кислотою:
 СН3СООН + NH4OH. СН3СООН + NH4OH.
Оскільки K д(NH4OH) = 1,78 × 10-5, а K д(СН3СООН) = 1,78 × 10-5, то середовище можна вважати нейтральним (рН» 7). Розглянемо ступіньчастий гідроліз (солі утвореної багатокислотною основою): - в іонній формі: І ступінь: Al3+ + 3СН3СОО- + H2O II ступінь: Al(OH)2+ + 2СН3СОО-+ H2O III ступінь: Al(OH)2+ + СН3СОО- + H2O - у молекулярній формі: Al(СН3СОО)3 + HOH AlOH(СН3СОО)2 + HOH Al(OH)2СН3СОО + HOH У даному випадку реакція середовища залежить від співвідношення констант дисоціації слабких кислоти і основи: вона може бути нейтральною, слабкокислою або слабколужною. Солі слабкої основи та слабкої кислоти можуть підлягати практично повністю прогідролізувати, якщо як продукт гідролізу утворюється дуже слабка кислота або дуже слабка основа (або одна з речовин є леткою). Наприклад:
Механізм гідролізу солей полягає в поляризаційній взаємодії іонів солі з їхньою гідратною оболонкою. Причому, чим сильніша ця взаємодія, тим інтенсивніше перебігає гідроліз. Гідроліз є оборотним процесом, тобто його кількісно можна характеризувати константою гідролізу K Г. Розглянемо оборотну реакцію, представлену рівнянням: KCN + H2O Запишемо даний процес у іонній формі: CN- + H2O Тоді вираз константи рівноваги реакції матиме такий вигляд:
У розбавлених розчинах солей рівноважна молярна концентрація води практично не змінюється ([H2O]» const), тому константа гідролізу для випадку солі, утвореної сильною основою і слабкою кислотою, визначається таким чином: K Г = K Р [H2O];
Оскільки йонний добуток води [H+][OH-] = 10-14, [OH-] = 10-14/[H+], то:
Аналогічно вираз константи гідролізу солі, утвореної слабкою основою і сильною кислотою, матиме вигляд
Отже, константа гідролізу солі залежить від іонного добутку води та константи дисоціації кислоти або основи. Для солі, утвореної слабкою основою і слабкою кислотою, константа гідролізу визначається як:
Ступенем гідролізу солі bгназивають відношення частки гідролізованої сол і до загальної кількості солі у розчині в момент досягнення стану рівноваги. Аналогічно закону розбавлення Ф.В. Оствальда константа гідролізу: K г» bг2 С (Х), де С (Х) − молярна концентрація електроліту у розчині, моль/л. Найчастіше гідроліз є небажаним явищем, тому для його послаблення слід користуватися концентрованими розчинами солей. Оскільки гідроліз є ендотермічним процесом, для його послаблення треба уникати підвищення температури.
Сповільнити процес гідролізу можна, якщо, відповідно до принципу Ле Шательє, підкислювати розчини солей, які мають рН < 7, та додавати луги, якщо рН > 7. У таких випадках можна практично повністю припинити гідроліз солі.
15.7. Запитання для самостійної підготовки
1. Які речовини належать до електролітів, неелектролітів? Сформулюйте основні положення теорії електролітичної дисоціації С.Арреніуса. 2. Що таке електролітична дисоціація? Які речовини здатні до електролітичної дисоціації? Поясніть причини дисоціації речовин на йони у полярних розчинниках. 3. Що характеризують за допомогою ступеня і константи електролітичної дисоціації? Від яких факторів вони залежать? 4. Розгляньте класи неорганічних речовин (кислоти, основи, солі) з погляду теорії електролітичної дисоціації С.Арреніуса. 5. Що називають іонним добутком води? Які фактори впливають на нього? Для чого потрібен водневий показник рН? Як його можна визначити? Як можна охарактеризувати кислотність середовища? 6. В яких випадках можливі обмінні реакції в розчинах електролітів? 7. Назвіть умови проходження обмінного процесу у розчині? 8. Які типи гідролізу можна виділити? Яким чином можна послабити (посилити) гідроліз? 9. Що називають ступенем гідролізу солі?
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.168.61 (0.011 с.) |

 .
.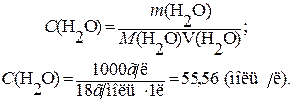
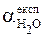 = 1,8 × 10-9).
= 1,8 × 10-9).
 = a2 С;
= a2 С; = [Н+][ОН-] =
= [Н+][ОН-] =  = 1,8 × 10-16 × 55,56 = 1,0 × 10-14 (моль2/л2)
= 1,8 × 10-16 × 55,56 = 1,0 × 10-14 (моль2/л2) , можна визначити рівноважні молярні концентрації гідроксильних іонів та іонів гідрогену за формулами:
, можна визначити рівноважні молярні концентрації гідроксильних іонів та іонів гідрогену за формулами: ; (15.5)
; (15.5) . (15.6)
. (15.6) = 1,0 × 10-14 моль2/л2.
= 1,0 × 10-14 моль2/л2. .
. NH4Cl NH4+ + Cl-.
NH4Cl NH4+ + Cl-.





 СН3СООK СН3СОО- + K+;
СН3СООK СН3СОО- + K+; Na2CO3 2Na+ + CO32-.
Na2CO3 2Na+ + CO32-.




 І ступінь: CO32- +
І ступінь: CO32- + 



 ІІ ступінь: НCO3- +
ІІ ступінь: НCO3- +  У молекулярному вигляді:
У молекулярному вигляді: СН3СООNH4 СН3СОО- + NH4+;
СН3СООNH4 СН3СОО- + NH4+;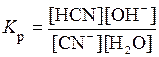 .
.
 ;
; . (15.13)
. (15.13) . (15.14)
. (15.14) . (15.15)
. (15.15)


