
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приклади розв’язання типових завдань з теми 7Содержание книги
Поиск на нашем сайте Завдання 1. Визначити типи хімічних зв’язків, які утворюються в сполуках: N2, O2, Cl2, CaF2, NaCl, Na, CH4, LiH, BCl3, HCl, CO, H2O. Розв’язання. У молекулах BCl3, CH4, H2O, CO, HCl реалізуються ковалентні полярні зв’язки між атомами, оскільки в цих сполуках різниця електронегативностей елементів DЕН У молекулах N2, O2, Cl2 здійснюється ковалентний неполярний тип зв’язку, оскільки до складу кожної з цих молекул входять атоми тільки одного хімічного елемента з однаковими значеннями електронегативностей (DЕН = 0). Речовини CaF2, NaCl мають іонний тип зв’язку оскільки різниця електронегативностей елементів (DЕН ³ 1,9). Завдання 2. Пояснити, чи можливе існування молекул PCl5 і NCl5 . Розв’язання.
 Отже, у нормальному стані валентність Фосфору становить три, але в молекулі PCl5 Фосфор п’ятивалентний (це його збуджений стан): Отже, у нормальному стані валентність Фосфору становить три, але в молекулі PCl5 Фосфор п’ятивалентний (це його збуджений стан):
Р* … 3 s 1 3 p 3 3 d 1 B * = 5.
Отже, молекула PCl5 може існувати, причому Фосфор утворює п’ять хімічних зв’язків за ковалентним обмінним механізмом. Молекула NCl5 не може існувати, тому що на другому валентному рівні атома Нітрогену немає d -підрівня:
7N 1 s 2 2 s 2 2 p 3 … B = 3.
Для атома Нітрогену не існує збудженого стану, саме тому він може утворювати лише три хімічні зв’язки за ковалентним обмінним механізмом. Завдання 3. Відомо, що валентний кут у молекулі SCl2 становить 90о, наведіть схему перекривання атомних орбіталей під час утворення цієї молекули. Чому ця молекула полярна?
17Cl … 3 s 23 p 5 … В = 1.
Завдання 4. Визначити типи гібридизації центральних атомів, зобразити геометричні конфігурації: а) молекули амоніаку NH3; б) молекули води Н2О. Розв’язання. а) Експериментально встановлено, що молекула амоніаку має пірамідальну геометричну форму, причому неподілена електронна пара (НЕП) атома Нітрогену напрямлена до однієї з вершин тетраедра. Всі зв’язки N-H у цій молекулі є рівноцінними, а валентні кути становлять 107°. Якщо виходити з електронних формул атомів, що складають молекулу NH3, хімічні зв’язки можуть бути утворені внаслідок перекривання трьох одноелектронних р -орбіталей атома Нітрогену з одноелектронними s -рбіталями трьох атомів Гідрогену.
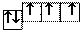 7N … 2 s 22 p 3 … B = 3; 7N … 2 s 22 p 3 … B = 3;
Але в цьому випадку утворюється молекула пірамідальної просторової будови з кутами між зв’язками N-H, близькими до 90°, що не збігаються з експериментальними результатами. Тому необхідно зробити припущення, що в атомі Нітрогену в момент утворення хімічного зв’язку відбувається sp3 -гібридизація валентних орбіталей. При цьому одна з гібридних орбіталей має неподіленими електронними парами НЕП, а три інші – по одному електрону:
Підсумковий дипольний момент молекули NH3 відрізняється від нуля
Отже, дві атомні орбіталі Оксигену утворюють два s-зв’язки з s -орбіталями атомів Гідрогену, а дві інші гібридні орбіталі заповнені неподіленими електронними парами (НЕП). Сумарний дипольний момент молекули Н2О відрізняється від нуля У розглянутих молекулах амоніаку і води атомні орбіталі з неподіленими електронними парами (НЕП) не беруть участі в утворенні хімічного зв’язку, тобто вони є незв’язуючими. Зв’язуюча електронна пара знаходиться між двома взаємодіючими атомами і займає менший простір, ніж незв’язуюча. Тому відштовхування незв’язуючої пари проявляється більшою мірою, ніж зв’язуючої. Зменшення валентних кутів у ряді молекул СН4, NH3 і Н2О (відповідно 109,5°; 107° i 104,5°) обумовлене наявністю та збільшенням кількості незв’язуючих
орбіталей центрального атома за однакового типу гібридизації (sp 3). Завдання 5. Визначити типи гібридизації атомних орбіталей, які відбуваються в молекулах: а) СаН2; б) BBr3; в) CІ4. Зобразити їх геометричні конфігурації, оцінити валентні кути.
Са … 4 s 2 … B = 0.
Са* … 4 s 14 p 1 … B * = 2.
Отже, можна припустити, що відбувається sp -гібридизація атомних орбіталей центрального атома - Кальцію. Валентний електрон атома Гідрогену, який бере участь в утворенні хімічного зв’язку, знаходиться на s -атомній орбіталі, яка має форму кулі:
Н Н Валентний кут у молекулі СаН2 становить 180°, тому вона лінійна. Хоча молекула СаН2 має два ковалентні полярні зв’язки Са-Н, унаслідок лінійної та симетричної будови вона є неполярною б) У нормальному стані атом Бору має валентність, що дорівнює одиниці:
5В 1 s 22 s 22 p 1 … B = 1.
У сполуці BBr3 Бор B* … 2 s 12 p 2 … B * = 3.
Оскільки всі зв’язки в молекулі BBr3 рівноцінні, можна констатувати, що вона має симетричну будову,
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 341; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.011 с.) |

 0 (Додаток 1).
0 (Додаток 1). Електронна будова атома Фосфору:
Електронна будова атома Фосфору:
 Розв’язання. Наводимо електронні конфігурації валентних рівнів атомів Сульфуру та Хлору:
Розв’язання. Наводимо електронні конфігурації валентних рівнів атомів Сульфуру та Хлору: 

 Обидва неспарені р -електро-ни Сульфуру беруть участь в утворенні двох s-зв’язків із двома атомами Хлору, які мають по одному неспареному електрону на р -атомній орбіталі. Тому молекула SCl2 має кутову будову з валентним кутом 90°. Полярність молекули пояснюється тим, що сума дипольних моментів окремих зв’язків, що утворюють молекулу, не дорівнює нулю (
Обидва неспарені р -електро-ни Сульфуру беруть участь в утворенні двох s-зв’язків із двома атомами Хлору, які мають по одному неспареному електрону на р -атомній орбіталі. Тому молекула SCl2 має кутову будову з валентним кутом 90°. Полярність молекули пояснюється тим, що сума дипольних моментів окремих зв’язків, що утворюють молекулу, не дорівнює нулю (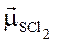 ≠ 0).
≠ 0).
 , тому молекула амоніаку полярна.
, тому молекула амоніаку полярна. 8O … 2 s 22 p 4 … B = 2;
8O … 2 s 22 p 4 … B = 2;

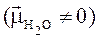 , тобто молекула води також полярна.
, тобто молекула води також полярна. Розв’язання. а) У нормальному стані атом Кальцію має валентність, що дорівнює нулю (на валентному рівні немає неспарених електронів):
Розв’язання. а) У нормальному стані атом Кальцію має валентність, що дорівнює нулю (на валентному рівні немає неспарених електронів):
 У сполуці СаН2 Кальцій двовалентний, тобто знаходиться у збудженому стані:
У сполуці СаН2 Кальцій двовалентний, тобто знаходиться у збудженому стані:

 .
. тривалентний, отже, знаходиться у збудженому стані:
тривалентний, отже, знаходиться у збудженому стані:
 а тип гібридизації атомних орбіталей Бору - sp 2 з валентним кутом 120о.
а тип гібридизації атомних орбіталей Бору - sp 2 з валентним кутом 120о.


