
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Використовуючи формулу (13.7), знаходимо ізотонічний коефіцієнтСодержание книги
Поиск на нашем сайте
(
За допомогою рівняння (13.6) знаходимо кількість іонів, що утворюються внаслідок дисоціації електроліту:
Таким чином, молекула даного електроліту дисоціює у воді з утворенням двох іонів. Задача 5. Обчислити ступінь дисоціації та концентрацію іонів Н+ у розчині хлорнуватистої кислоти НClО з концентрацією 0,01 моль/л. Константа дисоціації кислоти K Д = 5,8 × 10-8. Як зміниться концентрація іонів Н+, якщо до 1 л вихідного розчину кислоти додати 0,02 моль NaClО? Розв’язання. Хлорнуватиста кислота – слабкий електроліт, який у водному розчині дисоціює на іони згідно зі схемою НClО Ступінь дисоціації кислоти a << 1, тому використовуємо спрощену формулу закону Оствальда: K Д = a2 С (Х), де a = [H+]/ C (Х). У свою чергу, [H+] = [H+] = a = 2,41 × 10-5/0,01 = 2,44 × 10-3. Ступінь дисоціації слабкого електроліту сильно зменшується, якщо до розчину додати сильний електроліт з однойменним іоном. У цьому випадку під час дисоціації NaClО (a = 1) утворюються однойменні ClО--іони:
Тому у розчині збільшується концентрація іонів ClО- і, відповідно, зменшується концентрація іонів Н+. Це обумовлено зміщенням рівноваги (формула (15.13)) вліво – у напрямі процесу моляризації. Позначимо нову концентрацію іонів Н+ через х (тобто С(Н+) = х), тоді концентрація іонів СlО- дорівнюватиме х + С (СlО-), де С (СlО-) – концентрація іонів СlО-, що утворилися дисоціацією сильного електроліту NaClО: С (СlО-) = С (NaClО) = С (СlО-) = 0,02 / 1 = 0,02 (моль/л). Константа рівноваги процесу дисоціації кислоти (константа дисоціації) має вигляд
Через те, що хлорнуватиста кислота дуже слабкий електроліт, можна припустити, що рівноважна концентрація кислоти [HClO] близька до вихідної молярної концентрації: [HClO]» С(HClO). Тоді
х 2 + 0,02 х = 5,8 × 10-10. Оскільки величина х 2 достатньо мала, нею можна знехтувати, тоді 0,02 х» 5,8 × 10-10 х» 2,9 × 10-8. Отже, С (Н+) = 2,9 × 10-8 моль/л. Таким чином, концентрація іонів водню зменшиться приблизно в
Задача 5. Розрахуйте рН та рОН водних розчинів: а) нітратної кислоти з молярною концентрацією 0,001 моль/л; б) гідроксиду калію з молярною концентрацією 0,01 моль/л. Розв’язання: а) нітратну кислоту вважають сильним електролітом (a = 1), тому схему її дисоціації можна подати у вигляді
HNO3 = H+ + NO3-. Концентрація іонів H+ та NO3- у розчині сильного електроліту дорівнює молярній концентрації кислоти, тому [H+] = [NO3-] = C(HNO3) = 0,001 моль/л. Тоді рН = - lg 0,001 = 3; рОН = 14 - 3 = 11. б) гідроксид калію також є сильним електролітом (a = 1), тому схема його дисоціації KOH = K+ + OH-. Концентрації іонів K+ та ОН- у розчині цього сильного електроліту дорівнюють його молярній концентрації: [OH-] = [K+] = C (KOH) = 0,01 моль/л. Тоді розраховуємо рОН розчину за формулою (15.9): pОH = -lg [ОH-]; pОH = -lg 0,01 = 2; рН = 14 - 2 = 12. Задача 6. Розрахуйте рН та рОН водного розчину мурашиної кислоти НСООН з масовою часткою 0,05 (густина розчину - 1000 г/дм3), якщо константа дисоціації мурашиної кислоти дорівнює 2,1 · 10-4. Розв’язання. Мурашину кислоту відносять до слабких електролітів, тобто вона частково дисоціює за схемою НСООН Масову частку розчиненої речовини розраховуємо за формулою (13.8):
тобто маса мурашиної кислоти, що міститься в 1 л розчину: m (HCOOH) = m розч w(НСООН) = V розч d розч w(НСООН); m (HCOOH) = 1 × 1000 × 0,05 = 50 г. Молярна концентрація розчину кислоти: С (НСООН) = М (НСООН) = 46 г/моль; С (НСООН) = Оскільки aНСООН << 1, її константу дисоціації можна визначити за спрощеною формулою закону Оствальда: K Д = У свою чергу, aНСООН = [H+]/C(HCOOH), де [H+] - концентрація іонів H+ у розчині мурашиної кислоти, моль/л. Тоді [H+] = [H+] = Розраховуємо рН розчину за формулою (15.2): pH = -lg [H+]; pH = -lg(1,51 × 10-2) = 1,82. Оскільки рН + рОН = 14, то рОН = 14 - рН = 14 - 1,82 = 12,18. Задача 7. Концентрація насиченого при 20 °С водного розчину H2S дорівнює 0,1 моль/л. Обчисліть рівноважні концентрації іонів [H+], [HS-], [S2-]. Константи дисоціації кислоти Розв’язання. Сірководнева кислота є слабким електролітом, вона ступенево дисоціює за схемами: H2S HS- Оскільки Тоді [H+]» [HS-] = [H+]» [HS-] = Для приблизного розрахунку [S2-] використовуємо вираз
Враховуючи, що [H+]» [HS-], [S2-]» Отже, [H+] = 7,75 × 10-5 моль/л; [HS-] = 7,75 × 10-5 моль/л; [S2-] = 1 × 10-14 моль/л. Задача 8. За якої молярної концентрації оцтової кислоти у водному розчині її ступінь дисоціації дорівнює 0,01? Константа дисоціації оцтової кислоти дорівнює 1,8 × 10-5. Розв’язання. Оцтова кислота – слабкий електроліт, що частково дисоціює на іони:
СН3CООН онстанту дисоціації кислоти можна розрахувати за спрощеною формулою закону Оствальда: K Д» a2 С, С (СН3CООН) = 1,8 × 10-5/0,012 = 0,18 моль/л. Задача 9. Скільки грамів KOH міститься в 10 л розчину, рН якого дорівнює 11? Розв’язання. KOH – луг, сильний електроліт (a = 1), який у водному розчині повністю дисоціює на іони:
Для сильних електролітів концентрація іонів дорівнює молярній концентрації розчиненої речовини, тобто [OH-] = [K+] = C (KOH). Оскільки рОН = 14 - рН, рОН = 14 - 11 = 3, то [OH-] = 10-рОН, [OH-] = 10-3 моль/л. Тоді C(KOH) = 0,001 моль/л. Завдання 10. Напишіть у молекулярній та іонній формі рівняння реакцій і вказати сполуку, утворення якої визначає напрям перебігу процесу:
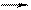  а) Pb(NO3)2 + KI; б) AlBr3 + AgNO3; в) FeCl3 + NH4OH; а) Pb(NO3)2 + KI; б) AlBr3 + AgNO3; в) FeCl3 + NH4OH;
Розв’язання: а) Pb(NO3)2 + 2KI = PbI2¯ + 2KNO3,
Pb2+ + 2I- = PbI2¯. Оскільки внаслідок взаємодії утворюється поганорозчинний йодид свинцю, рівновага у системі зміщується у напрямі прямої реакції.
б) AlBr3 + 3AgNO3 = 3AgBr¯ + Al(NO3)3,
Взаємодія у процесі відбувається з утворенням малорозчинного броміду срібла: Ag+ + Br- = AgBr¯.
Fe3+ + 3NH4OH = Fe(OH)3¯ + 3NH4+. У цьому випадку взаємодія сильного електроліту FeCl3 та слабкого NH3×H2O º NH4OH приводить до утворення осаду Fe(OH)3, тому рівновага зміщується у напрямі прямого процесу.
HCO3- + H+ = CO2 + Н2О. Утворюється газоподібна речовина, тому рівновага у системі зміщується вправо. Як можна простежити за цими прикладами, зміщення іонних рівноваг іде у напрямі, в якому найповніше відбувається зв’язування іонів, а концентрації вільних, незв’язаних іонів, що залишаються у розчині, стають мінімально можливими.
ДОДАТКИ
Додаток 1 Відносна електронегативність атомів
Додаток 2 Стандартні ентальпії утворення D
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 400; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.175.129 (0.009 с.) |

 =
=  ):
):
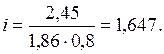

 (іони)
(іони) Н+ + ClО-.
Н+ + ClО-.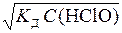 ;
; = 2,41 × 10-5 (моль/л);
= 2,41 × 10-5 (моль/л); NaClО Na+ + ClО-.
NaClО Na+ + ClО-. ;
; .
. ;
;
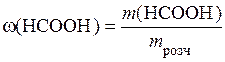 ,
, ;
; моль/л.
моль/л. С (НСООН).
С (НСООН). ;
; = 1,51 × 10-2 моль/л.
= 1,51 × 10-2 моль/л.
 );
); ).
). , дисоціацією за другим ступенем можна знехтувати.
, дисоціацією за другим ступенем можна знехтувати.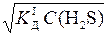 ;
; = 7,75 × 10-5 моль/л.
= 7,75 × 10-5 моль/л.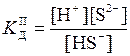 .
. = 1 × 10-14 моль/л.
= 1 × 10-14 моль/л. KOH K+ + OH-.
KOH K+ + OH-.
 г) NaHCO3 + HNO3.
г) NaHCO3 + HNO3.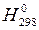 , ентропії
, ентропії  та енергії Гіббса D
та енергії Гіббса D 



