
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Періодичний закон і періодична системаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Д. І. Менделєєва
1869 р. – офіційна дата відкриття періодичного закону Д. І. Менделєєва. Сучасне формулювання закону має вигляд: властивості елементів, а також форми та властивості їхніх сполук знаходяться у періодичній залежності від величин зарядів ядер атомів. Періодична система хімічних елементів графічно відображає періодичний закон Д.І.Менделєєва. Закономірності, виражені нею, зумовлені монотонним збільшенням кількості валентних електронів і періодичним повторенням однакових валентних електронних конфігурацій. Періодичність зміни хімічних властивостей елементів розглядають по періодах і групах (підгрупах). Період – це послідовність елементів горизонтального ряду, у межах якого їхні властивості змінюються від типового металу до типового неметалу. Група – це сукупність подібних за властивостями елементів, що знаходяться в одному вертикальному ряді. Підгрупа – це сукупність найбільш подібних за властивостями елементів. До головних підгруп відносять усі s - i p -елементи незалежно від періоду, тоді як до побічних підгруп входять d- i f -елементи великих періодів. Атоми елементів, що знаходяться у різних періодах, але в одній підгрупі періодичної системи, мають однакове розташування електронів на зовнішніх і попередніх енергетичних рівнях, чим і зумовлені їх подібні хімічні властивості. Початок заповнення електронами нового енергетичного рівня відповідає початку наступного періоду, причому загальна кількість енергетичних рівнів у атомі збігається з номером періоду, у якому знаходиться елемент. Сумарне число валентних електронів (електронів s - і p -орбіталей зовнішнього шару або s - зовнішнього та неповністю заповнених d -орбіталей попереднього шару) визначає номер групи. Однак слід пам’ятати, що у короткому варіанті періодичної системи всього вісім груп, крім того, VIII група великих періодів містить тріади елементів (по три d -елементи). У лантаноїдів і актиноїдів, розміщених у нижній частині періодичної таблиці, валентними електронами є ns -електрони та (n – 2) f -електрони (де n – номер зовнішнього енергетичного рівня). Таким чином, причиною розподілу групи на головну (А) та побічну (В) підгрупи є заповнення електронами різних підрівнів в атомах елементів однієї й тієї самої групи. Саме розташування валентних електронів у атомі визначає хімічні властивості елемента. Наприклад, усі s - (окрім Гідрогену та Гелію), d - і f -елементи - метали. Серед p -елементів до металів належать ті, атоми яких мають на зовнішньому енергетичному рівні не більше чотирьох електронів (за винятком Бору, Карбону та Силіцію, які є неметалами, хоч і мають на зовнішньому енергетичному рівні менше чотирьох електронів, та Стибію, Бісмуту й Полонію, які мають на зовнішньому енергетичному рівні більше чотирьох електронів, але є металами). Слід пам’ятати, що розподіл елементів на метали і неметали досить умовний. Під металічними властивостями, зазвичай, розуміють здатність елемента втрачати свої валентні електрони, а під неметалічними – здатність приєднувати електрони до валентного енергетичного рівня. Однак неметали також здатні віддавати свої валентні електрони більш електронегативному атому, зокрема при утворенні хімічного зв’язку. За положенням елемента у періодичній системі можна записати електронну конфігурацію його атома та передбачити основні хімічні властивості. У свою чергу, за розміщенням електронів на рівнях і підрівнях можна визначити положення елемента у періодичній системі. Міцність зв’язку валентних електронів з ядром залежить від заряду ядра атома, відстані між певним електроном і ядром, а також від екрануючого впливу інших електронів. У всіх атомах, крім атома Гідрогену, вплив ядра на валентні електрони сильно послаблений через екранування його електронами внутрішніх енергетичних рівнів. На міцність зв’язку електрона з ядром також впливає ефект проникнення, а саме: імовірність знаходження навіть валентних електронів у просторі поблизу ядра не дорівнює нулю. Ефект проникнення посилює міцність зв’язку зовнішніх електронів з ядром. Кількісною мірою міцності зв’язку електрона з ядром (мірою металічних властивостей) є енергія іонізації. Енергія іонізації (І, кДж/моль) – це енергія, яка витрачається на відрив електрона від 1 моль незбудженого ізольованого атома. У загальному вигляді: А0 + І ® А+ +
Найлегше від атома відірвати перший електрон, тому енергія іонізації для кожного наступного електрона збільшується: I1 < I2 < … < In . У свою чергу, значення енергії іонізації залежить від типу відірваних електронів. Зі зростанням значення головного квантового числа s -електрони мають більшу ймовірність проникнення у простір поблизу ядра (s -електрони наче проникають за p - або d -електрони попереднього шару); проникнення електронів з однаковими значеннями головного квантового числа максимальне для s -електронів, менше для р - і мінімальне для d -електронів. Цим пояснюється збільшення енергії іонізації зі зростанням заряду ядра атома у побічних підгрупах (d -елементів), тобто зверху вниз. У головних підгрупах (s - та p -елементів) зі збільшенням заряду ядра атома енергія іонізації зменшується внаслідок посилення екрануючої дії електронів попередніх енергетичних рівнів. У разі однакової кількості енергетичних рівнів послідовне заповнення електронами зовнішнього рівня обумовлює послаблення металічних властивостей елементів зліва направо, тобто у межах одного періоду зі збільшенням заряду ядра атома. Кількісною мірою неметалічних властивостей є енергія спорідненості до електрона. Спорідненість до електрона (Есп, кДж/моль) – це енергія, яка виділяється або поглинається під час приєднання електрона до 1 моль незбудженого ізольованого атома. У загальному вигляді А0 + Не всі атоми легко приєднують електрони, тому цей процес може супроводжуватися як виділенням тепла, так і поглинанням. Спорідненість до електрона суттєво залежить від електронної конфігурації атома: максимальну Есп мають р -елементи сьомої групи, найменшу - атоми з повністю заповненими (ns 2 і ns 2 np 6) або напівзаповненими (ns 2 np 3) енергетичними підрівнями. Енергія іонізації та енергія спорідненості до електрона характеризують властивості ізольованого атома. Для характеристики властивостей атомів у хімічних сполуках Л. Полінгом (1932 р.) було введено поняття електро-негативності. Електронегативність (ЕН) – це кількісна характеристика здатності атома у молекулі відтягувати до себе електронні хмари інших атомів. Зазвичай зі збільшенням заряду ядра атома електронегативність у межах одного періоду збільшується, а у головних підгрупах - зменшується. Найбільшу електронега-тивність має Флуор та р -елементи сьомої групи, а найменшу - s -елементи першої групи. Для оцінки ЕН елементів існує, наприклад, шкала відносних електро-негативностей Полінга, а також метод Маллікена, згідно з яким: ЕН =
5.3. Запитання для самостійної підготовки
1. Недоліки перших моделей будови атома: Томсона та Резерфорда. Модель атома Гідрогену за теорією Бора. Сформулюйте постулати Бора, основні принципи квантової механіки. 2. Сучасні уявлення про будову атома. Які елементарні частинки називають протонами, нейтронами, електронами? 3. У чому виявляється двоїста корпускулярно-хвильова природа частинок мікросвіту, зокрема, електрона? Гіпотеза Луї де Бройля. 4. Чому неможливо описати рух електрона в атомі за допомогою певної траєкторії? Принцип невизначеності Гейзенберга. 5. Для чого застосовують рівняння Шредінгера? Що називають атомною орбіталлю? Який фізичний зміст має ½y (x, y, z)½2? 6. Який фізичний зміст квантових чисел (головного, орбітального, магнітного та спінового)? Яка супідрядність існує між ними? Які два квантових числа характеризують енергію атомної орбіталі? 7. Яку інформацію про хімічні властивості елементів можна одержати, аналізуючи електронні формули атомів? 8. Що розуміють під збудженим станом атома? Поясніть, чому Флуор завжди одновалентний, а Хлор може виявляти перемінну валентність? Які елементи періодичної системи мають незмінну валентність? 9. У чому причина періодичного повторення властивостей хімічних елементів? Яке сучасне формулювання періодичного закону? За якими ознаками елементи розміщують в одній групі; в одній підгрупі періодичної системи? 10. Що характеризує енергія іонізації? Як вона змінюється в періоді, у головних і побічних підгрупах? Відповідь обґрунтуйте за допомогою прикладів. 11. Що характеризує енергія спорідненості до електрона? Як вона змінюється зі збільшенням заряду ядра атома в періоді; у головних підгрупах періодичної системи? Відповідь обґрунтуйте на прикладах. 12. Які властивості елементів можна охарактеризувати за допомогою електронегативності елементів? Як її можна оцінити?
6. Приклади розв’язання типових завдань з теми 5 7. Завдання 1. На якому енергетичному рівні знаходиться атомна орбіталь, яку характеризує хвильова функція y421? Яка це орбіталь? Розв’язання. Для орбіталі, яку характеризує хвильова функція y Завдання 2. Знайти кількість атомних орбіталей для енергетичного стану 4 f. Визначити максимальне число електронів, які характеризуються цим енергетичним станом. Розв’язання. Для четвертого енергетичного рівня головне квантове число n = 4. Для f- підрівня орбітальне квантове число l = 3, тому магнітне квантове число ml може набувати такі значення: -3; -2; -1; 0; 1; 2; 3. Отже, загальна кількість f- орбіталей дорівнює семи. Згідно з принципом заборони Паулі, в атомі не може бути двох електронів з однаковим набором усіх чотирьох квантових чисел. Отже, кожна орбіталь максимально може вмістити лише два електрони, які мають протилежні спіни, а максимальна кількість електронів на певному підрівні може становити 2(2 l + 1).
Тоді кількість електронів, які характеризуються енергетичним станом 4 f, дорівнює 14:
Завдання 3. Поясніть, чому не можуть реалізуватися наведені електронні конфігурації: а) 2 d 3 і б) 4 p 8. Розв’язання. а) Оскільки головне квантове число n =2, це другий енергетичний рівень. Для для d- АО орбітальне квантове число l = 2. Але для n = 2 орбітальне квантове число може набувати лише два значення l = 0, 1, оскільки l = 0, 1… n – 1. Тому на другому енергетичному рівні можливі тільки s - і p -підрівні. Отже, конфігурація 2 d 3 не може реалізуватися. б) Оскільки головне квантове число n = 4, це четвертий енергетичний рівень. Тому можливими значеннями орбітального квантового числа є l = 0, 1, 2, 3. Для р -АО l = 1. Згідно з принципом Паулі, максимальна кількість електронів на підрівні може бути 2(2 l + 1), тобто на р -підрівні може міститися тільки шість електронів, що й пояснює неможливість реалізації конфігурації 4 p 8. Завдання 4. Яким набором квантових чисел характеризується стан кожного з семи електронів, які знаходяться на 4 d- атомній орбіталі (4 d 7)? Розв’язання. Наводимо набір квантових чисел для семи 4 d- електронів у порядку заповнення ними атомних орбіталей (табл. 6.1). Таблиця 6.1. Набір квантових чисел для електронів, які характеризуються станом 4 d 7
Для наведених електронів також можна вибрати інші значення спінових квантових чисел m S, відповідно: -1/2; -1/2; -1/2; -1/2; -1/2; 1/2; 1/2, оскільки, згідно із правилом Хунда, у межах одного підрівня електрони заповнюють АО таким чином, щоб сума магнітних спінових квантових чисел за абсолютною величиною була максимальною. Завдання 5. Визначити значення квантових чисел для всіх електронів атома, який має електронну конфігурацію: 1 s 22 s 22 p 63 s 23 р 2. Розв’язання. Згідно з принципом найменшої енергії, електрони заповнюють атомні орбіталі в порядку зростання їх енергії. Електронні оболонки атомів зображають за допомогою електронних формул: перша цифра вказує значення головного квантового числа, яке чисельно збігається з номером енергетичного рівня; літерою позначають орбітальне квантове число, а цифра над літерою позначає кількість електронів, що знаходяться в цьому енергетичному стані (табл. 6.2). Таблиця 6.2. Набір квантових чисел для атома з електронною конфігурацією 1 s 22 s 22 p 63 s 23 р 2
Завдання 6. Розмістити наведені атомні орбіталі у порядку зростання їхніх енергій: 4 f; 6 s; 2 p; 3 s; 4 d; 4 p; 5 s; 3 d. Розв’язання. Заповнення електронами атомних орбіталей атома відбувається за принципом найменшої енергії, а саме: електрони заповнюють атомні орбіталі атома у порядку зростання їх енергій. Користуючись двома правилами В.Клечковського: 1) зі зростанням заряду ядра атома електрони заповнюють атомні орбіталі у порядку зростання суми головного і орбітального квантових чисел n + l; 2) у разі однакових значень суми n + l першою заповнюється електронами атомна орбіталь, яка має менше значення головного квантового числа n,
розміщуємо запропоновані нам атомні орбіталі у порядку зростання їхніх енергій: 2 p;3 s;3 d;4 p;5 s;4 d;6 s;4 f (табл. 6.3). Таблиця 6.3. Розрахунок енергій АО за правилами Клечковського
Задача 7. Скласти: а) електронні формули атома Германію 32Ge у нормальному і збудженому станах; б) електронні формули іонів Al3+ і S2– . Розв’язання. а) У незбудженому (нормальному) стані атом має мінімально можливий запас енергії. З поглинанням кванту (квантів) енергії атом переходить до збудженого стану. При цьому спарені електрони, розміщені на одному енергетичному рівні, роз’єднуються, тобто у збудженому стані один з електронів, якщо це можливо, переходить на вакантну (вільну) атомну орбіталь з більшою енергією у межах одного рівня. Таким чином,
У збудженому стані атом Германію має таку електронну конфігурацію: 32Ge* 1 s 22 s 22 p 63 s 23 p 63 d 104 s 14 p 3 … B * = 4.
б) Електронна формула атома Алюмінію має вигляд: 13Al0 1 s 22 s 22 p 6 3 s 23 p 1, тоді як іона Al+3: 1 s 22 s 22 p 63 s 03 p 0. Тобто катіону алюмінію Al+3 бракує трьох електронів порівняно з атомом Алюмінію Al0. Електронна конфігурація атома Сульфуру має вигляд: 16S0 1 s 22 s 22 p 6 3 s 23 p 4, а іона S-2: 1 s 22 s 22 p 63 s 23 p 6; тобто в аніоні S-2 на два електрони більше, ніж в атомі Сульфуру S0. Завдання 8. Визначити положення хімічних елементів у періодичній таблиці за допомогою їхніх електронних формул. До яких електронних родин належать ці елементи: а)1 s 22 s 22 p 63 s 23 p 6 4 s 1; б)1 s 22 s 22 p 63 s 23 p 63 d 10 4 s 24 p 5; в)1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 6 4 d 35 s 2? Розв’язання. Залежно від того, на якому з підрівнів під час заповнення електронної оболонки атома розміщується останній з валентних електронів електронів, елементи відносять до s-, p-, d- або f- електронних родин. Причому елементи s- і p- електронних родин формують головні підгрупи періодичної системи, а d- і f- електронних родин - побічні підгрупи. Слід пам’ятати, що у короткому варіанті періодичної таблиці f- елементи (лантаноїди й актиноїди) розміщені окремо - внизу таблиці. а) Запропонований елемент - Калій 19K. Оскільки його електрони розміщені на чотирьох енергетичних рівнях (n max = 4), він знаходиться у четвертому періоді таблиці Д. І. Менделєєва і належить до s -електронної родини, бо останнім у нього заповнюється електронами саме s -підрівень: …4 s 1. Отже, Калій знаходиться в
головній підгрупі І групи (s -електронна родина, один валентний електрон). б) Запропонований елемент - Бром 35Вr знаходиться у четвертому періоді таблиці Д. І. Менделєєва, оскільки максимальне значення головного квантового числа n max дорівнює чотирьом. Бром належить до р -електронної родини, оскільки його останній електрон заповнює р -підрівень: …4 s 24 р 5, та до головної підгрупи VII групи, отже загальна кількість його валентних електронів становить сім (2 + 5 = 7). в) Запропонований елемент - Ніобій 41Nb належить до d -електронної родини, оскільки останніми електронами заповнюється саме d -підрівень: …5 s 24 d 3. Ніобій знаходиться в побічній підгрупі V групи (кількість валентних електронів становить 3 + 2 = 5). Він розташований у п’ятому періоді таблиці Д. І. Менделєєва, тому що максимальне значення головного квантового числа n max = 5. Завдання 9. Пояснити, чому елементи P, As і Sb, що розташовані в V групі таблиці Д. І. Менделєєва, достатньо сильно відрізняються за властивостями від елементів V, Nb і Ta, які містяться в тій самій групі. Розв’язання. Запропоновані елементи п’ятої групи: P, As, Sb, V, Nb і Ta мають однакову кількість валентних електронів - п’ять, що збігається з номером групи. Тому всі вони здатні проявляти максимальну валентність, що дорівнює п’яти. Наведемо розташування валентних електронів за підрівнями для цих елементів: 15Р … 3 s 23 p 3; 23V … 3 d 34 s 2; 33As … 4 s 24 p 3; 41Nb … 4 d 35 s 2; 51Sb … 5 s 25 p 3; 51Ta … 5 d 36 s 2. Оскільки у Р, As i Sb валентні електрони розташовані на ns - i np -атомних орбіталях, вони розміщені у головній підгрупі періодичної системи. V, Nb, Ta - елементи побічної підгрупи, оскільки валентними в них є ns - i (n - 1) d -електрони.
Ось чому елементи Р, As, Sb i V, Nb, Ta хоча і знаходяться в одній групі періодичної системи, але достатньо сильно відрізняються за властивостями. Завдання 10. Дати повну характеристику елемента 50Sn за допомогою його розміщення в періодичній системі хімічних елементів. Розв’язання. 50Sn: 1) порядковий номер елемента - 50; 2) заряд ядра атома (протонне число) Z = +50; 3) кількість протонів у ядрі Np = 50; 4) відносна атомна маса Аr (Sn) = 118,6; 5) число нейтронів у найбільш поширеному ізотопі як різниця між відносною атомною масоюелемента і кількістю протонів у ядрі атома): Nn =68; 6) число електронів в атомі Ne = 50; 7) загальна кількість енергетичних рівнів - 5; 8) розподілення електронів по енергетичних рівнях і підрівнях в атомі Стануму має вигляд: 50Sn 1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 10 5 s 25 p 2; 9) 10) Sn* …5 s 15 p 3; 11) Станум належить до р -електронної родини, оскільки останнім заповнюється р -підрівень; 12) розміщений у п’ятому періоді (n max= 5) головної підгрупи (р -елемент) четвертої групи (кількість валентних електронів становить 2 + 2 = 4);
13) його максимальний позитивний ступінь окиснення +4; електронна формула іона Sn+4 має вигляд: Sn+4 1 s 22 s 22 p 63 s 23 p 63 d 104 s 24 p 64 d 105 s 05 p 0; 14)
15) вищий оксид SnO2 має амфотерний характер; 16)
властивості: SnO2 H2O = H2SnO3 або Sn(OH)4 Завдання 11. У якого з елементів І групи: а) Калію 19K чи Рубідію 37Rb; б) Аргентуму 47Ag чи Купруму 29Cu яскравіше виражені металічні властивості? Розв’язання. а) Калій і Рубідій – елементи головної підгрупи І групи періодичної системи. У головних підгрупах зі збільшенням заряду ядра атома (тобто зверху вниз) енергія іонізації зменшується, а металічні властивості, відповідно, посилюються. Отже, Рубідій має меншу енергію іонізації, а тому - яскравіше виражені металічні властивості, ніж у Калію; б) Аргентум і Купрум – елементи побічної підгрупи І групи періодичної системи. У побічних підгрупах зі збільшенням заряду ядра атома енергія іонізації зростає, а металічні властивості, відповідно, послаблюються. Таким чином, Купрум, що розміщений вище за Аргентум та має менший заряд ядра атома, має меншу енергію іонізації, і тому яскравіше виражені металічні властивості, ніж у Аргентуму. Завдання 12. У якого з елементів - Кальцію 20Ca чи Германію 32Ge - яскравіше виражені металічні властивості?
Розв’язання. Обидва елементи розміщені в IV періоді. Експериментально було встановлено, що в межах періоду зі зростанням заряду ядра ефективні радіуси атомів (тобто радіуси атомів, зв’язаних тим чи іншим типом хімічного зв’язку) зменшуються. Це обумовлене тим, що електрони, які послідовно заповнюють атомні орбіталі з близькими значеннями енергії, зі зростанням заряду ядра сильніше притягуються до нього. Тому у межах періоду від лужного металу до інертного газу (тобто зліва направо) енергія іонізації у цілому зростає; але це зростання є немонотонним, тобто неоднаковим для елементів головних і побічних підгруп. Отже, у Кальцію 20Ca, який розміщений в періоді набагато лівіше за Германій 32Ge та має менший заряд ядра атома, енергія іонізації менша, а металічні властивості виражені яскравіше за Германій. Завдання 13. Визначити: а) у Силіцію 14Si чи у Сульфуру 16S краще виражені неметалічні властивості; б) який з елементів Хлор 17Cl чи Йод 53I яскравіше виявляє неметалічні властивості? Розв’язання. а) Силіцій і Сульфур знаходяться в ІІІ періоді періодичної системи, але Силіцій розташований лівіше за Сульфур. У загальному випадку енергія спорідненості до електрона по періоду зі збільшенням заряду ядра атома (тобто зліва направо) зростає. Тому у Сульфуру енергія спорідненості до електрона більша, і неметалічні властивості виражені краще, ніж у Силіцію; б) Хлор 17Cl і Йод 53I є елементами головної підгрупи VII групи періодичної системи. У головних підгрупах енергія спорідненості до електрона з ростом заряду ядра атома (тобто зверху вниз) зменшується. Отже, у Хлору, який розташований вище за Йод та має менший заряд ядра атома, енергія спорідненості до електрона більша, тому його неметалічні властивості виражені яскравіше, ніж у Йоду.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 553; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.013 с.) |

 .
. ®
® 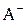 ± Есп.
± Есп. .
. (y421), головне квантове число n = 4. Отже, вона знаходиться на четвертому енергетичному рівні. Оскільки орбітальне квантове число l = 2, це d -орбіталь. Значення магнітного квантового числа ml = 1, тобто це одне з п’яти можливих розміщень у просторі ml = -2, -1, 0, +1, +2.
(y421), головне квантове число n = 4. Отже, вона знаходиться на четвертому енергетичному рівні. Оскільки орбітальне квантове число l = 2, це d -орбіталь. Значення магнітного квантового числа ml = 1, тобто це одне з п’яти можливих розміщень у просторі ml = -2, -1, 0, +1, +2.
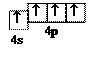 Валентність атома визначається кількістю неспарених електронів. Тому у нормальному стані валентність Германію дорівнює двом (В = 2), а у збудженому – чотирьом (В * = 4), що є максимальною валентністю Германію.
Валентність атома визначається кількістю неспарених електронів. Тому у нормальному стані валентність Германію дорівнює двом (В = 2), а у збудженому – чотирьом (В * = 4), що є максимальною валентністю Германію.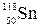 (визначається
(визначається кількість неспарених електронів -, тобто валентність атома в нормальному стані В = 2;
кількість неспарених електронів -, тобто валентність атома в нормальному стані В = 2; валентність атома Стануму в збудженому стані В * = 4; оскільки відбувається роз’єднання електронів та перехід на АО з більшою енергією
валентність атома Стануму в збудженому стані В * = 4; оскільки відбувається роз’єднання електронів та перехід на АО з більшою енергією H4SnO4.
H4SnO4.


