
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приклади розв’язання типових задач з теми 13Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Задача 1. Розрахуйте молярні частки глюкози C6H12O6 та води у розчині, який містить 0,1 моль глюкози і 10 моль води. Розв’язання. Визначаємо сумарну кількість молів речовин (глюкози і води) у розчині: п розч = n (С6Н12О6) + n (Н2О) = 0,1 + 10 = 10,1 (моль). Знаходимо молярну частку глюкози у розчині за формулою:
χ(C6H12O6) = n (С6Н12О6)/ n розч; χ(C6H12O6) = 0,1/10,1 = 0,0099 (0,99 %). Відзначимо, що сума будь-яких часток для двокомпонентної системи дорівнює одиниці, тобто χ(А) + χ(В) = 1. У цьому випадку χ(Н2О) = 1 - χ(C6H12O6) = 1 - 0,0099 = 0,9901 (99,01%). Задача 2. Змішали 1 л вуглекислого газу СО2 і 2 л кисню. Розрахуйте об’ємну частку СО2 в одержаній газовій суміші. Розв’язання. Визначаємо загальний об’єм одержаної суміші: V сум. = V (СО2) + V (О2) = 1 + 2 = 3 (л). Розраховуємо об’ємну частку СО2 у газовій суміші за формулою: j (Х) = V (Х)/ V с; j (СО2) = 1/3 = 0,33 (33 %). Задача 3. У 200 мл розчину міститься 10 г хлориду натрію. Розрахуйте масову концентрацію хлориду натрію. Розв’язання. Масова концентрація хлориду натрію r(Х) = m (Х)/Vрозч; r(NaCl) = 10/0,2 = 50 г /л = 50 (к г /м3). Задача 4. У 200 мл розчину міститься 4,9 г сульфатної кислоти. Обчисліть молярну концентрацію сульфатної кислоти. Розв’язання. Знаходимо молярну концентрацію сульфатної кислоти С (Н2SO4) за формулою (13.5), якщо її молярна маса М (Н2SO4) = 98 г /моль:
Задача 5. Яка маса ортофосфатної кислоти Н3РО4 потрібна для приготування 2 л розчину з молярною концентрацією еквівалентів Н3РО4 0,1 моль/л? Розв’язання. Молярну концентрацію еквівалентів (нормальність) розраховуємо за формулою:
де m (X) - маса розчиненої речовини, г. Молярна маса хімічних еквівалентів ортофосфатної кислоти становить
Тоді маса ортофосфатної кислоти, що потрібна для приготування розчину заданої концентрації, становитиме:
При розрахунках також можна використовувати формулу, яка зв’язує молярну масу та молярну масу еквівалентів речовини: С (1/z*·X) = z*· C (X), де z* − число еквівалентності. Задача 6. Скільки грамів гідроксиду калію потрібно для приготування 5 л розчину, якщо масова частка KOH у розчині w(KOH) = 0,2, а його густина d розч = 1,28 г /см3? Розв’язання. Знаходимо масу розчину: m розч = V розч d розч; m розч = 5000 × 1,28 = 6400 г. Масу KOH знаходимо за допомогою формули
w(B)= m (B)/ m розч, (13.8) де w(B)- масова частка розчиненої речовини. m (KOH) = w(KOH) m розч; m (KOH) = 0,2 × 6400 = 1280 г. Задача 7. Яка маса сульфатної кислоти потрібна для приготування 2 л розчину з концентрацією 2 моль/л? Розв’язання. З формули (13.5), знаючи молярну масу сульфатної кислоти М (Н2SO4 ) = 98 г /моль, одержуємо m (H2SO4) = M (H2SO4) C (H2SO4) V розч; m (H2SO4) = 98 × 2 × 2 = 392 (г). Задача 8. Обчисліть масу води, яку необхідно додати до 200 г розчину хлориду натрію з масовою часткою w(NaCl) = 2 %, щоб одержати інший розчин з масовою часткою w¢(NaCl) = 0,9 %. Розв’язання. Розраховуємо масу NaCl у вихідному розчині, користуючись формулою (13.8): m (NaCl) = m розч w(NaCl); m (NaCl) = 200 × 0,02 = 4 (г). Після розведення маса розчину становитиме: m ¢розч = m (NaCl)/w¢(NaCl); m ¢розч = 4/0,009 = 444 (г). Розраховуємо масу води, яку необхідно додати, щоб одержати потрібний нам розчин: D m (H2O) = m ¢розч - m розч = 444 - 200 = 244 (г). Задача 9. Тиск насиченої пари водного розчину, що містить нелетку розчинену речовину, на 2 % нижчий за тиск насиченої пари чистої води. Ви-значіть моляльність розчиненої речовини у розчині, якщо V розч = 1 дм3 (1 л). Розв’язання. Оскільки розчинена речовина є нелеткою, вона не переходить у парову фазу, тому тиск насиченої пари над розчином визначається тільки тиском насиченої пари розчинника. Якщо взяти
У свою чергу, молярна частка розчиненої речовини становить:
де n (A) i n (B) - кількість молів розчинника та розчиненої речовини відповідно. Оскільки густина води d (Н2О) = 1000 г /дм3, в одному літрі кількість молів води становитиме: n (Х) = n (H2O) Після підстановки одержуємо
звідки n (B) = 1,134 моль. Моляльність розчину визначаємо за формулою (13.3): Cm (x) = n(B)/m (A) = 1,134/1 = 1,134 (моль/к г розчинника). Задача 10. Розрахуйте температуру кипіння 0,1 молярного водного розчину глюкози C6H12O6, якщо ебуліоскопічна стала води дорівнює
Розв’язання. Використовуємоформулу переходу від молярної концентрації С(Х) до моляльності:
де d розч - густина розчину, г /см3, М (B)- молярна маса розчиненої речовини, г /моль. Оскільки розчин достатньо розбавлений, можна вважати, що d розч» d (Н2О) = 1 г /см3, М (C6H12O6) = 180 г /моль, тоді
Згідно з другим законом Рауля (формула (13.2)) визначаємо підвищення температури кипіння розчину глюкози заданої концентрації:
Тоді температура кипіння цього розчину становитиме:
Задача 11. Розчин, що містить 1,22 г бензойної кислоти С6Н5СООН у 100 г сульфуркарбону, кипить при 46,53 °С. Температура кипіння чистого сульфуркарбону - 46,3 °С. Обчисліть ебуліоскопічну cталу сульфуркарбону СS2. Розв’язання. Підвищення температури кипіння розчину порівняно з температурою кипіння чистого розчинника:
З другого закону Рауля (13.2)
де m (A) - маса розчинника, г; М (B)= М (С6Н5СООН) = 122 г /моль. Звідси випливає, що
Задача 12. Водний розчин, який містить нелетку розчинену речовину, замерзає при 271,5 К. Визначіть температуру кипіння розчину і тиск насиченої пари розчинника над розчином при температурі 298 К. Відомо, що кріоскопічна cтала води Розв’язання. Температуру замерзання розчину можна розраховувати за формулою:
Тоді зниження температури замерзання розчину порівняно з температурою замерзання чистого розчинника становить:
Знаходимо моляльність розчиненої речовини у розчині за формулою: Cm (x) = Cm (x) = 1,65/1,86 = 0,887 (моль/к г розчинника). Тоді
Звідси температура кипіння розчину становить:
Тиск насиченої пари розчинника над розчином знаходимо за першим законом Рауля (формула (13.1а)), де молярну частку розчинника розраховуємо за формулою:
Оскільки d (H2O) = 1000 г /дм3, то в одному літрі води кількість молів води можна визначити за формулою: n (Н2О) = d (H2O) n (Н2О) = 1000 × 1/18 = 55,56 (моль). Тоді кількість молів розчиненої речовини становить (див. формулу (13.3)):
n (B) = 0,887 × 1 = 0,887 моль, якщо маса розчинника Тиск насиченої пари над розчином розраховуємо за формулою:
Задача 13. Розчин, що містить 0,32 г сірки в 3,96 г бензолу, кипить при температурі 80,91 °С; Розв’язання: Визначаємо зниження температури кипіння розчину порівняно з температурою кипіння чистого розчинника
Молярну масу сірки знаходимо за формулою (13.2):
M (Sn) = Знаючи атомну масу сірки Ar (S) = 32 та її молярну масу М (S) = 32 г /моль, розраховуємо, зі скількох атомів сірки складається молекула сірки в розчині бензолу: n = 256/32 = 8 (атомів). Отже, сірка у розчині бензолу асоційована, її молекула складається з восьми атомів. Задача 14. Обчисліть осмотичний тиск розчину при 0 °С, якщо в 1,4 л розчину міститься 6,3 г глюкози С6Н12О6. Розв’язання. У 1,4 л розчину міститься n (С6Н12О6) = n (С6Н12О6) = Осмотичний тиск розчину визначаємо за допомогою формули (13.4). Якщо t =0 °С (273,15 К), для заданого розчину глюкози тиск
якщо
15. РОЗЧИНИ ЕЛЕКТРОЛІТІВ Програмні питання
Електроліти. Електролітична дисоціація, її причини та наслідки. Основні положення теорії Арреніуса. Особливості води як розчинника. Класифікація електролітів. Сильні та слабкі електроліти. Основи, кислоти, солі з точки зору електролітичної дисоціації. Особливості дисоціації амфотерних гідроксидів. Ступінь дисоціації, його залежність від концентрації електроліту та температури. Роль розчинника у процесі дисоціації.
Константа дисоціації як кількісна міра сили слабкого електроліту. Закон розбавлення Оствальда. Особливості ступінчастої дисоціації електролітів. Добуток розчинності. Іонний добуток води, водневий показник рН, кислотність середовища. Індикатори, способи визначення рН. Стан сильних електролітів у розчинах. Умови перебігу реакцій обміну в розчинах. Гідроліз солей, типи гідролізу. Вплив різних факторів на стан гідролітичної рівноваги, зміна рН водних розчинів солей. Способи послаблення гідролізу
|
|||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 822; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.134.108.183 (0.007 с.) |


 ;
; (моль/л).
(моль/л). , (13.7)
, (13.7) - молярна маса хімічних еквівалентів речовини, г /моль;
- молярна маса хімічних еквівалентів речовини, г /моль; =
= 


 = 100 %, то pA = 98 %, оскільки зниження тиску за умовою задачі D pA = 2 %. Згідно з першим законом Рауля (формула (13.1)) одержуємо:
= 100 %, то pA = 98 %, оскільки зниження тиску за умовою задачі D pA = 2 %. Згідно з першим законом Рауля (формула (13.1)) одержуємо: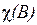
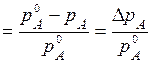 ;
;

 ,
,
 = 55,56 (моль).
= 55,56 (моль).
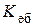 (Н2О) = 0,52 К×к г /моль.
(Н2О) = 0,52 К×к г /моль.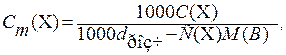
 (моль/ г розчинника).
(моль/ г розчинника). =
=  =
=  +
+  ;
; = 46,53 - 46,3 = 0,23 °С.
= 46,53 - 46,3 = 0,23 °С. ,
,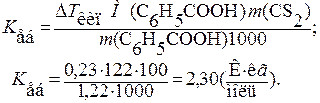
 (Н2О) = 1,86 К×к г /моль, а ебуліоскопічна стала води
(Н2О) = 1,86 К×к г /моль, а ебуліоскопічна стала води  =
= 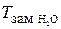 -
- 
 =
=  -
-  /
/  +
+  / M (H2O);
/ M (H2O); = С m(x) m (A);
= С m(x) m (A);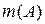 =
=  = 1 к г.
= 1 к г. =
= 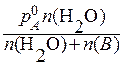 ;
; = 3117,43 (Па)
= 3117,43 (Па) ;
;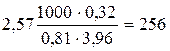 (г /моль).
(г /моль). ; М (С6Н12О6) = 180,16 г /моль;
; М (С6Н12О6) = 180,16 г /моль; = 0,035 (моль).
= 0,035 (моль).
 = 1,4 × 10-3 м3, R = 8,31 Дж/(моль×К).
= 1,4 × 10-3 м3, R = 8,31 Дж/(моль×К).


