
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Властивості розчинів неелектролітівСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Розчини - це гомогенні (однорідні) термодинамічно стійкі фізико-хімічні системи змінного складу, які містять два або більше компонентів, а також продукти їх взаємодії. Розчини можуть бути газові (наприклад, повітря), рідкі (водні та неводні) і тверді (наприклад, сплави). У природі та промисловості найпоширенішими є рідкі розчини, зокрема, водні. Відзначимо, що поділ компонентів розчину на розчинену речовину та розчинник найчастіше є умовним, особливо у разі необмеженої розчинності компонентів один в одному. Зазвичай розчинником називають той компонент, який при утворенні розчину не змінює свій агрегатний стан або об’єм якого більше. Кількісно склад розчинів та багатокомпонентних систем виражають за допомогою часток розчиненої речовини (молярної, масової, об’ємної тощо) або її молярної концентраціїї, моляльності та нормальності. Майбутнім інженерам необхідно не тільки знати різні способи вираження складу багатокомпонентних систем, але й володіти методами перерахування одного способу в інший (див. підрозд. 14). Розчини не можна розглядати тільки як механічні суміші компонентів. Змінний, у достатньо широких межах, склад розчинів не виключає хімічної взаємодії між компонентами - процесу сольватації. Сучасна теорія утворення розчинів є органічним поєднанням “фізичної” та “хімічної” теорій. Розчинення будь-якої речовини завжди супроводжується тепловим ефектом D H 0розч, значення якого залежить від двох основних складників: теплового ефекту руйнування кристалічної решітки - ендотермічний процес (D Н 0реш > 0) і теплового ефекту сольватації - екзотермічний процес (D Н 0 сольв < 0). Отже, D H 0розч = D Н 0реш + D Н 0 сольв. Залежно від того, яка з цих складових більша за абсолютним значенням, процес розчинення є екзо- чи ендотермічним, тобто супроводжується виділенням або поглинанням теплоти. Розчинення більшості кристалічних речовин, наприклад NH4Cl, NaCl, NH4NO3 та ін. у воді - ендотермічний процес, оскільки ïD Н 0решï>ïD Н 0сольвï. Під час розчинення сильних кислот та лугів у воді виділяється теплота, оскільки при цьому утворюються гідратні сполуки і виконується співвідношення ïD Н 0решï<ïD Н 0сольвï. Утворення розчину – самовільний процес. Його рушійною силою (за сталих температури і тиску) є зменшення вільної енергії Гіббса системи порівняно з вільною енергією вихідних складників розчину (тобто D G 0розч < 0). Оскільки D G 0розч = D H 0розч - T D S 0розч, на зміну вільної енергії Гіббса у процесі розчинення впливають обидва фактори: і ентальпійний - D H 0розч, і ентропійний - T D S 0розч. Розчинам приписують індивідуальні (обумовлені особливостями розчине-ної речовини) та загальні властивості (залежать тільки від кількості частинок розчиненої речовини у системі та не залежать від природи розчиненої речовини). До загальних властивостей належать тиск насиченої пари розчинника над розчином нелеткої речовини, температури кипіння і замерзання, осмотичний тиск розчинів. Експериментально було встановлено, що тиск насиченої пари (тобто пари, яка знаходиться у рівновазі зі своєю рідиною) розчинника над розчиномнелеткої речовини-неелектроліта менший за тиск насиченої пари над чистим розчинником. Це явище обумовлено деякими причинами. Оскільки розчинена речовина нелетка (її температура кипіння набагато більша за температуру кипіння розчинника), у парову фазу можуть переходити тільки молекули розчинника. Однак у розчині частина поверхні поділу фаз рідина - пара зайнята частинками розчиненої речовини. Це зменшує кількість молекул розчинника, які здатні переходити з поверхні у парову фазу за одиницю часу. Кількість молекул розчинника, що конденсуються на поверхні, не змінюється, оскільки загальна площа поверхні поділу фаз залишається сталою. Крім того, деяка частина молекул розчинника, які знаходяться в об’ємі рідини, взаємодіє з частинками розчиненої речовини, утворюючи нестійкі хімічні сполуки - сольвати. Це також приводить до зменшення кількості молекул розчинника, що переходять у парову фазу і, як наслідок, до зниження тиску насиченої пари розчинника над розчином. Математично перший закон Рауля має вигляд
де
де ni - кількість речовини, моль. Відносне зниження тиску насиченої пари розчинника над розчином порівняно з чистим розчинником Враховуючи, що для двокомпонентної системи χ(A) = 1 - χ(B), цей закон також має інший математичний вираз:
де χ(A) - молярна частка розчинника: Тобто тиск насиченої пари розчинника над розчином прямо пропорційний мольній частці розчинника. Зниження температури замерзання D T зам та підвищення температури кипіння D Т кип розчину відносно відповідних температур чистого розчинника безпосередньо пов’язані зі зниженням тиску насиченої пари розчинника над розчином. Якщо тиск насиченої пари над розчином досягає атмосферного тиску, то розчин починає кипіти. Кристалізація розчину починається тоді, коли тиск насиченої пари над розбавленим розчином дорівнює тиску над твердою фазою. Математично другий закон Рауля записують так: D Т кип = D T зам = де
де m(B) - маса розчиненої речовини, г; М(B) - молярна маса розчиненої речовини, г /моль; m(A) - маса розчинника, к г. Розглянемо фізичний зміст цих сталих. Ебуліоскопічна стала температури замерзання одномоляльного розчину неелектроліту відносно відповідних температур для чистого розчинника. Для води, наприклад, ці величини набувають таких значень:
Розглянуті закономірності справедливі тільки для розбавлених розчинів неелектролітів, оскільки в більш концентрованих розчинах частка молекул розчинника, які беруть участь у процесі сольватації, збільшується, і, як наслідок, властивості таких розчинів сильніше залежать від індивідуальних властивостей розчиненої речовини. Розчини електролітів мають певні особливості, обумовлені процесами електролітичної дисоціації та сольватації (гідратації) іонів. Осмос Осмосом називають процес, який являє собою здійснення практично односторонньої дифузії молекул розчинника через напівпроникну мембрану. Рушійною силою осмосу, а також кількісною мірою його проходження є різниця осмотичних тисків двох розчинів з різними концентраціями. Осмотичний тиск характеризують як силу, яку необхідно прикласти з боку розчину, щоб зупинити проходження осмосу. Згідно із законом Вант-Гоффа осмотичний тиск розчину p чисельно дорівнює тиску, який створила б розчинена речовина, якщо б при тій самій температурі вона була газоподібною і займала об’єм, що дорівнює об’єму розчину. Математично закон Вант-Гоффа має вигляд p = С (Х) RТ, (13.4) де R - універсальна газова стала; Т - абсолютна температура, К; С (Х) - молярна концентрація розчину (молярність), моль/л:
де n(B) - кількість молів розчиненої речовини; V розч- об’єм розчину, л. Із закону Вант-Гоффа випливає, що за однакових температур різні розчини неелектролітів з однаковою молярною концентрацією мають однаковий осмотичний тиск, тобто є ізотонічними. 13.3. Запитання для самостійної підготовки
1. Дайте визначення поняттям: розчин, розчинник, розчинена речовина. Які способи вираження складу багатокомпонентних систем вам відомі? Які з них не залежать від температури? 2. Через які стадії проходить процес розчинення кристалічної речовини в рідинах? У яких випадках розчинення є екзо-, а в яких - ендотермічним процесом? 3. Що називають тепловим ефектом розчинення? Від величини яких складників залежить його значення? Як змінюються ентальпія, ентропія та енергія Гіббса системи під час розчинення різних речовин? 4. Що називають процесом сольватації (гідратації)? Який вид взаємодії реалізується у сольватних (гідратних) сполуках? 5. Який пар називають насиченим? Як змінюється тиск насиченої пари розчину зі збільшенням температури? Сформулюйте та поясніть закони Рауля. До яких розчинів їх можна застосувати? 6. Чому розчини нелетких речовин киплять при більш високій, а замерзають при більш низьких температурах, ніж чисті розчинники? 7. Як можна експериментально визначити і теоретично розрахувати ебу- ліоскопічну та кріоскопічну сталі розчинників? Розкрийте їхній фізичний зміст. 8. Охарактеризуйте явище осмосу та природу осмотичного тиску. Яким законам він підкоряється у розбавлених розчинах неелектролітів? 9. У чому полягають особливості законів Ф.М.Рауля та Я.Х.Вант-Гоффа для розчинів електролітів? Що таке ізотонічний коефіцієнт, у чому його фізичний зміст?
|
||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 509; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.012 с.) |

 , (13.1)
, (13.1) - тиск насиченої пари над чистим розчинником; pA - тиск насиченої пари розчинника над розчином; χ(B) - молярна частка розчиненої речовини, яку для двокомпонентної системи визначають як
- тиск насиченої пари над чистим розчинником; pA - тиск насиченої пари розчинника над розчином; χ(B) - молярна частка розчиненої речовини, яку для двокомпонентної системи визначають як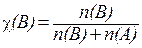 ,
, дорівнює молярній частці роз-чиненої речовини (перший закон Рауля).
дорівнює молярній частці роз-чиненої речовини (перший закон Рауля). (13.1а)
(13.1а) .
.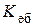 Cm (x); (13.2)
Cm (x); (13.2) Cm (x),
Cm (x), ; (13.3)
; (13.3) , (13.5)
, (13.5)


