
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2. Розчини. Термодинаміка розчинівСодержание книги
Поиск на нашем сайте
Розчин – гомогенна термодинамічна стійка система змінного складу, яка складається з двох або більше компонентів. Склад компонентів в розчинах може змінюватись у досить широких межах, тому розчини нагадують механічні суміші. В той же час між компонентами можлива хімічна взаємодія, що наближує розчини до хімічних сполук (рис.2.1).
Один з компонентів розчину прийнято рахувати розчинником. Як правило, розчинником називають кількісно найбільшу складову частину розчину. Якщо розчин утворений твердим і рідким або газоподібним і рідким компонентами, розчинником називають рідкий компонент, тобто той, який в процесі утворення розчину не змінює свого агрегатного стану. Але з термодинамічної точки зору всі компоненти розчину є рівноцінними. В природі найбільш „універсальним” розчинником є вода. Вона здатна розчиняти велику кількість речовин з утворенням розчинів. Так, вода морів і океанів вміщує тисячі компонентів (йони металів, комплексні неорганічні йони, велику кількість органічних речовин тощо). В організмах рослин, тварин, людини вміст води у різних тканинах і органах складає від 20 до 99,5 мас. %. Водні розчини (плазма крові, міжклітинна рідина) виконують роль транспортної системи процесів живлення, продуктів метаболізму, антитіл, газів, ензимів тощо. Водні розчини є активними учасниками реакцій окиснення – відновлення, гідролізу, гідратації, набухання, травлення, кровотворення, утворення секретів і ексекретів, забезпечення тургору тканин. Унікальність води як розчинника пов'язана з її фізичними і хімічними властивостями. Молекули води зв'язані між собою водневими зв'язками, які утворюють угрупування – кластери.
У зв'язку з цим вода має аномально високі значення температур плавлення і кипіння. Її густина у твердій фазі (льоду) значно менша за густину у рідкій фазі. Ця особливість не дає льоду опускатись на дно водоймищ і океанів, тому вони не замерзають повністю, що зумовило виникнення живих організмів саме в розчині океанів. Таким чином, розчинник – вода грає велику роль у всіх біохімічних процесах, що відбуваються в рослинах, грунтах водоймищах, в живих організмах, у більшості хімічних процесів, які застосовують в промисловості. Розрізняють рідкі, газоподібні та тверді розчини. Як вже визначалось рідкі розчини – це суміші рідин або розчини твердих речовин і газів у рідинах. Газоподібні розчини – це суміш газів. Наприклад, повітря – газовий розчин кисню, азоту, диоксиду карбону. Тверді розчини або сплави утворюються під час охолодження рідких розплавів. Важливою характеристикою розчину є склад та концентрація компонентів. Кількість кожного компонента розчину може бути виражена в одиницях, в зв'язку з чим склад розчину виражають декількома способами – масовою часткою, молярністю, нормальністю, титром.
Таблиця 2.1
В таблиці приведені формули, які дозволяють проводити необхідні перерахунки при переході від одного способу вираження концентрацій до іншого. Розчинність речовин у воді. Здатність речовин розчинятись при дотику з розчинником залежить від зміни енергії Гібсса ∆G. Ця величина визначається різницею:
де ∆Hm – інтегральна теплота розчинення; ∆Sm – зміна ентропії.
Розчинення речовин у воді відбувається з утворенням розчинів до їх насичення. Цей процес супроводиться або з виділенням теплоти із системи (екзотермічний процес), або з її поглинанням системою (ендотермічний процес). Екзотермічні процеси записуються з від'ємним знаком, а ендотермічні – з позитивним. В кожному із випадків розчинення можлива також зміна градієнта теплоти розчинення з переходом через екстремум. Тобто всі речовини можуть бути охарактеризовані „екзотермічністю” теплоти розчинення. Причому, з екзотермічної точки зору розглядаються як процеси розчинення з виділенням теплоти, так і ендотермічні. При цьому головне – оцінити рівень і напрям зміни екзотермічності. До речі, підвищення екзотермічності ендотермічних ефектів розчинення спостерігається при зменшенні кількості теплоти, що виділяється. Розчинення речовин може відбуватися без затрат енергії, в таких системах розчинність безмежна. В системах де розчинність обмежена необхідно забезпечувати певні термодинамічні умови розчинення. Розчинність більшості речовин з підвищенням температури зростає, проте для деяких сполук вона може зменшуватись. Зменшення розчинності з підвищенням температури характерне для речовин, розчинення яких супроводиться виділенням теплоти. Це, наприклад, Са(ОН)2, кристалогідрати FeSO4 ∙ Н2О, Nа2СО3 ∙ Н2О та ін. (рис.2.4.).
Розчинення речовин у воді супроводжується утворенням в розчині гідратів, що підтверджується виділенням відповідних сполук з розчинів у вигляді кристалогідратів. Отже, існування в розчинах і твердому стані гідратів (сольватів), а також теплові ефекти, що супроводять процеси розчинення, свідчать про те, що розчини є проміжним станом між механічними сумішами і хімічними сполуками. Кінетика розчинення твердих речовин. Під час розчинення рідка фаза завжди переміщується відносно твердої поверхні речовини, що розчиняється. Це відбувається внаслідок того, що густина рідкої фази неоднакова у твердої поверхні і далі від неї. Тому розчинені частинки речовини переносяться рідиною в масу розчину, а молекули розчинника проникають (дифундують) до твердої поверхні, яка розчиняється. Такий процес називають дифузійним. В процесі розчинення у поверхні кристалу, що розчиняється, утворюється насичений розчин СНАС . (рис.2.5).
По мірі віддалення від поверхні кристалу концентрація розчину різко зменшується до С₀. Загальне рівняння швидкості розчинення має вигляд:
де N – маса речовини, яка розчиняється; S – площа поверхні кристалів; t - час; Коефіцієнт К визначають за рівнянням:
де b - емпірична константа; D – коефіцієнт дифузії; Dr = rт-rр – різниця між густинами твердої речовини і розчинника; h - динамічна в'язкість. Рухомою силою розчинення є недонасиченність розчину, тобто різниця між концентрацією насичення СНАС. і фактичною концентрацією розчину С0. Підвищення температури на 10 К збільшує швидкість розчинення у 1,5–2 рази. Інтенсивність розчинення залежить від площі поверхні контакту фаз S. Наприклад, чим менший розмір мають кристали, тим швидше вони розчиняються. Розчинення речовин продовжується до тих пір, поки не наступить рівність хімічних потенціалів йонів в розчину і в кристалі:
де При цьому рідка і тверда фази знаходяться в динамічній рівновазі. Теплота розчинення. На величину теплового ефекту утворення розчинів великою мірою впливає кількісне співвідношення речовини, яка розчиняється, і розчинника. В зв'язку з цим розрізняють інтегральні Змішування n1 молей розчинника з
де Н – ентальпія розчину, що утворився при співвідношенні молей n2 / n1 або Відношення зміни ентальпії
Табличні значення Диференціальній теплоті розбавлення відповідає теплота розчинення 1 моль речовини у нескінченно великій кількості розчинника. Між інтегральною теплотою розчинення і диференціальною теплотою розбавлення існує зв'язок:
де При розчиненні твердих тіл у рідині, що супроводжується перебігом двох процесів: руйнування кристалічної решітки (ендотермічний процес) і гідратації йонів (екзотермічний процес), інтегральна теплота розчинення являє собою алгебраїчну суму цих процесів:
де ΔНm – перша теплота розчинення, кДж/моль; Перша теплота розчинення (її позначають ще ΔНm→0) дорівнює різниці ентальпій розчиненої речовини при безкінечному розчиненні (
Теплота розчинення Теплоту гідратації іонів ∆НГ обчислюють за законом Гесса і калориметричних даних. Її відносять до 1 моль твердого кристалогідрату і певної кількості води. Наприклад, експериментально встановлено, що:
За законом Гесса теплота утворення кристалогідрату відповідає рівнянню:
звідки: ∆Н(ТГ) = ∆Н(Т1) - ∆Н(ТГ), (2.8) де ∆Н(Т1), ∆Н(Т2) – теплоти розчинення відповідно безводної солі і кристалогідрату, кДж/моль; ∆Н(Т Г ) – теплота утворення гідрату, кДж/моль. В точці
де Якщо пересичений розчин розбавляти розчинником до утворення насиченого або ненасиченого розчину, то зміну ентальпії переходу від пересиченого НПЕР. до насиченого ННАС. та Нm , обчислюють за рівнянням:
В загальному випадку тепловий ефект розбавляння водою насиченого або ненасиченого розчину з урахуванням зміни концентрації від
При розчиненні газу в рідині тепловий ефект розчинення обчислюють за рівнянням Клазіуса-Клапейрона:
де Т – температура; ∆НВИП. – молярна теплота випаровування; р/ро – відносний тиск насиченої пари і стандартний тиск; R – універсальна газова стала. Для більшості систем розчинення газів супроводжується зменшенням об'єму розчину. З підвищенням температури розчинність газів зменшується. Для систем, у яких розчинення газів супроводжується поглинанням теплоти, при підвищенні температури розчинність збільшується. Змішування і розчинення рідин. Змішування двох розчинів речовини 2 з утворенням третього розчину, яке супроводиться виділенням (поглинанням) теплоти, приведено в табл. 2.2. Якщо вода у вихідних і змішаного розчинів не зв'язана з компонентами, тобто є вільною, ентальпію розчинення речовин у змішаному розчині розраховують за рівнянням: ∆Н = nIII2 (∆HIIIm(2) - ∆HIm(2)) + nIII3 (∆HIIIm(3) - ∆НIIm(3)). (2.13) Універсальні теплоти розчинення речовин 2 і 3 ∆НIIIm(2) і ∆НIIIm(3) в утвореному розчині ІІІ знаходять з урахуванням молярних співвідношень Змішування двох водних розчинів, які містять різні речовини (число молей n2 і n3), часто супроводжується хімічною взаємодією з утворенням нової речовини (число молей n4). При цьому можливе виділення цієї речовини в якусь фазу. Спостерігаємий при цьому тепловий ефект ∆Н є сумою окремих теплових ефектів – теплоти змішування розчинів ∆НЗМ., теплоти утворення продуктів реакції ∆НР і теплоти їх фазового переходу ∆НФ.П.: ∆Н = ∆НЗМ. + ∆НР + ∆НФ.П.. (2.14) Часто змішування розчинів призводить до кристалізаційних процесів.
Таблиця 2.2
|
|||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.134.161 (0.022 с.) |


 Механічна суміш
Механічна суміш



 Розчин
Розчин

 Хімічна сполука
Хімічна сполука


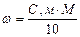



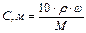

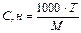

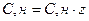


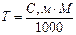

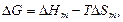



 (2.1)
(2.1) - швидкість розчинення, яка віднесена до одиниці площі контакту фаз; К – коефіцієнт швидкості розчинення; СНАС. – концентрація насиченого розчину при даній температурі; С0 – концентрація речовини, яка розчиняється в рідкій фазі.
- швидкість розчинення, яка віднесена до одиниці площі контакту фаз; К – коефіцієнт швидкості розчинення; СНАС. – концентрація насиченого розчину при даній температурі; С0 – концентрація речовини, яка розчиняється в рідкій фазі.
 (2.2)
(2.2)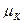 – хімічний потенціал кристалу; m0 – хімічний потенціал речовини в стандартному стані;
– хімічний потенціал кристалу; m0 – хімічний потенціал речовини в стандартному стані; 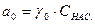 – активність речовини в розчині;
– активність речовини в розчині;  – коефіцієнт активності;
– коефіцієнт активності;  – концентрація насиченого розчину.
– концентрація насиченого розчину. і диференціальні (парціальні) L теплоти розчинення (розбавляння).
і диференціальні (парціальні) L теплоти розчинення (розбавляння). молями речовини, що розчиняється, супроводжується зміною ентальпії:
молями речовини, що розчиняється, супроводжується зміною ентальпії: (2.3)
(2.3) ;
; 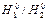 - ентальпії розчинника і речовини, що розчиняється.
- ентальпії розчинника і речовини, що розчиняється. до числа розчинених молей n2 представляє інтегральну (в перерахунку на 1 моль) теплоту розчинення
до числа розчинених молей n2 представляє інтегральну (в перерахунку на 1 моль) теплоту розчинення 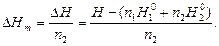 (2.4)
(2.4) (2.5)
(2.5) – інтегральна теплота розчинення при концентрації Сm1, кДж/моль; Сm – молярність розчину.
– інтегральна теплота розчинення при концентрації Сm1, кДж/моль; Сm – молярність розчину. (2.6)
(2.6)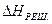 – енергія решітки, кДж/моль;
– енергія решітки, кДж/моль; 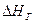 – сумарна теплота гідратації йонів, кДж/моль.
– сумарна теплота гідратації йонів, кДж/моль. ) і чистої речовини (
) і чистої речовини (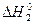 ):
): (2.7)
(2.7)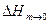 кожної речовини у воді є постійною величиною для даної температури. Для складного розчину вона визначається складом базового розчину.
кожної речовини у воді є постійною величиною для даної температури. Для складного розчину вона визначається складом базового розчину.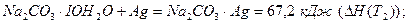


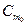 для насиченого розчину, знаючи температурну залежність ∆Нm нас. = ƒ( т ), можна визначити диференціальну теплоту розчинення 1 моль речовини в насиченому розчині LНАС., яку називають також останньою теплотою розчинення:
для насиченого розчину, знаючи температурну залежність ∆Нm нас. = ƒ( т ), можна визначити диференціальну теплоту розчинення 1 моль речовини в насиченому розчині LНАС., яку називають також останньою теплотою розчинення: (2.9)
(2.9) – остання теплота розчинення, кДж/моль;
– остання теплота розчинення, кДж/моль; 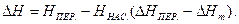 (2.10)
(2.10) до
до  і параметрів змішуваних частин системи обчислюють за формулою:
і параметрів змішуваних частин системи обчислюють за формулою: (2.11)
(2.11) (2.12)
(2.12) і
і  , де сумарна кількість молей води
, де сумарна кількість молей води  , а для розчинених речовин
, а для розчинених речовин  і
і  .
.


