
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особливості розчинів електролітівСодержание книги
Поиск на нашем сайте У розчинах електролітів експериментально спостерігають деякі відхилення значень осмотичного тиску, змін температур кипіння і замерзання розчинів від закономірностей, встановлених для розчинів неелектролітів. Для досягнення відповідності між теорією і дослідом Вант-Гофф запропонував ввести множник і (і > 1), пізніше названий ізотонічним коефіцієнтом. Він показує, у скільки разів збільшується загальна кількість частинок розчиненої речовини внаслідок процесу електролітичної дисоціації, тобто процесу розкладання речовини на іони під впливом полярних молекул розчинника. Дані про ізотонічні коефіцієнти, які можна виміряти, наприклад, за допомогою тиску насиченої пари, осмотичного тиску або змін температури кипіння і замерзання розчинів електролітів, дозволили С.А.Арреніусу створити теорію електролітичної дисоціації. Якщо молекула електроліту під час дисоціації розкладається на n іонів, реальна кількість частинок визначається добутком іС = (1 - a) С + n a С, де n a С - це кількість іонів; (1 - a) С - кількість молекул, які непродисоціювали. Звідки і = 1 + a(n - 1), (15.2) де a - ступінь дисоціації, який дорівнює відношенню кількості молекул речовини, що розклалися на іони, до загальної кількості розчинених молекул. Для сильного бінарного електроліту АВ (n = 2), який дисоціює повністю (a = 1) за схемою:
і = 1 + 1(2 - 1) = 2. Отже, реальна концентрація іонів у такому розчині буде вдвічі більша від вихідної концентрації молекул розчиненої речовини. Для розчинів електролітів рівняння осмотичного тиску Вант-Гоффа та законів Рауля мають вигляд p = іC (Х) RT;
D Т кип = i D T зам = i
Напрям перебігу процесів у розчинах електролітів. Іонно-молекулярні рівняння
Взаємодія в розчинах за участю електролітів зводиться до реакцій обміну іонів. Відмінною рисою обмінних реакцій у розчинах є те, що в процесі даного виду взаємодії не відбувається зміни ступінів окислення елементів. До обмінних реакцій у розчинах належать реакції нейтралізації, осадження, гідролізу, комплексоутворення та ін. Напрям обмінних реакцій між електролітами визначають здатністю іонів утворювати: · малорозчинні сполуки, що випадають в осад (наприклад, AgCl, BaSO4 та ін.); · малодисоційовані сполуки (Н2О, СН3СООН, НСN та ін.); · іони (HS-, HCO3- тощо); газоподібні речовини (H2S, CO2, NH3 тощо). Записуючи йонно-молекулярні рівняння, у вигляді йонів записують тільки сильні електроліти, а слабкі електроліти, газоподібні речовини, нерозчинні або малорозчинні сполуки, малодисоційовані речовини записують у вигляді молекул, оскільки у розчині вони переважно знаходяться у вигляді молекул або кристалів. Внаслідок процесів, які проходять у розчинах, більш вірогідно утворюються найслабкіші електроліти. Тобто йони реагують один з одним тільки у випадках, коли відбувається їх зв’язування, наприклад:
в іонно-молекулярному вигляді: 2Na+ + S2- + 2H+ + 2Cl- = 2Na+ + Cl- + H2S. Оскільки іони Na+ та Cl- не беруть участі у взаємодії (іони-спостерігачі), їх вилучають з рівняння реакцій і одержують скорочене йонно-молекулярне рівняння: S2- + 2H+ = H2S. Розглянемо наступний приклад − реакцію солеутворення під час взаємодії основи та кислоти:
NH4OH + H+ + Cl- = NH4+ + Cl- + H2O; Тоді скорочене йонно-молекулярне рівняння має вигляд: NH4OH + H+ = NH4+ + H2O -. Зазначимо, якщо у процесі реакції зв’язування іонів не відбувається, то реакція не здійснюється. Наприклад,
CH3COOH + Na+ + Cl- = CH3COO- + Na+ + H+ + Cl- CH3COOH = CH3COO- + H+ Тобто реакція зліва направо не перебігає. Слід пам’ятати, що серед основ сильними електролітами є тільки основи лужних та лужно-земельних металів: LiOH, NaOH, KOH…, Ca(OH)2, Ba(OH)2, … Сильні кислоти є також сильними електролітами. Їх не так багато: HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4, H2CrO4, H2Cr2O7. Розчинні у воді солі також в іонних реакціях записуємо у вигляді іонів (додаток 4).
|
||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 242; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.104.128 (0.007 с.) |

 АВ А Х+ + В Х-,
АВ А Х+ + В Х-, ;
;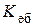 Cm (x);
Cm (x); Cm (x). (15.3)
Cm (x). (15.3)


