
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способи вираження концентрації розчинівСодержание книги
Поиск на нашем сайте Важливою характеристикою будь-якого розчину є відносний вміст у ньому розчиненої речовини і розчинника, що називається концентрацією. На практиці використовують такі способи вираження концентрації: 1. Молярна частка – відношення кількості даного компонента до загальної кількості речовин у розчині. Для двокомпонентних розчинів: 2. Масова (об’ємна) частка – відношення маси (об’єму) розчиненої речовини до загальної маси (об’єму) розчину: Частки виражають у частинах від одиниці або у відсотках. 3. Молярна концентрація – відношення кількості розчиненої речовини до об’єму розчину:
4. Моляльна концентрація (моляльність) – відношення кількості розчиненої речовини до маси розчинника (кількість молів розчиненої речовини, що припадає на 1 кг (1000 г) розчинника):
5. Молярна концентрація еквівалентів (нормальна концентрація) – відношення кількості еквівалентів розчиненої речовини до об’єму розчину: CE 6. Титр Т – маса розчиненої речовини в 1см3 (1 мл) розчину:
де ME – молярна маса еквівалентів розчиненої речовини, m1 (m2) – маса розчиненої речовини (розчинника), г; M1 – молярна маса розчиненої речовини, г/моль; V – об'єм розчину, л; n1 (n2) – кількість молів розчиненої речовини (розчинника). Колігативні властивості розчинів
Властивості розбавлених розчинів, які залежать тільки від кількості нелеткої розчиненої речовини, називаються колігативними властивостями. До них належать зниження тиску пари розчинника над розчином, підвищення температури кипіння та зниження температури замерзання, а також осмотичний тиск. Осмотичний тиск π в розбавлених розчинах неелектролітів обчислюють за рівнянням Вант-Гоффа: π = СMRT, де СM – молярна концентрація розчину. Зниження тиску пари розчинника над розчином, Dр (закон Рауля): p1 = x1p0: Δp = p0 – p1 = x2p0 = p0 Зниження температури замерзання і підвищення температури кипіння розчинів неелектролітів відносно чистого розчинника: ΔTзам = Tзам(розчинника) – Tзам(розчину) = KкрCm ΔTкип = Tкип(розчину) – Tкип(розчинника) = KЕCm, де Ккр – кріоскопічна стала розчинника, КЕ – ебуліоскопічна стала розчинника, Сm – моляльна концентрація розчину. Для розчинів електролітів в рівняння, що описують колігативні властивості неелектролітів, вводять поправочний (ізотермічний) коефіцієнт Вант-Гоффа (і): π = iCМRT; ΔTзам = iKкрCm; ΔTкип = iKЕCm. Приклад 1. В 1 кг води розчинено 55 г сульфатної кислоти. Густина розчину дорівнює 1,220 г/мл. Знайти: а) масову частку сульфатної кислоти у розчині; б) молярну концентрацію кислоти; в) моляльну концентрацію кислоти; г) молярну концентрацію еквівалентів кислоти (нормальність); д) молярну частку кислоти у розчині. Розв’язання а) Масову частку знаходимо за формулою: ω ω б) Молярну концентрацію кислоти знаходимо за формулою:
в) Моляльну концентрацію кислоти знаходимо за формулою:
г) Молярну концентрацію еквівалентів кислоти знаходимо за формулою:
д) Молярну долю кислоти у розчині знаходимо за формулою:
Відповідь: а) 5,2 %; б) 0,65 моль/л; в) 0,56 моль/л; г) 1,5 моль/л; д) 1 %.
*1000 – переведення мілілітрів у літри ** Контрольні питання і задачі 1. Що називається розчином? 2. Наведіть способи вираження концентрації розчинів. 3. Які властивості розчинів називаються колігативними? 4. Знайдіть масову частку глюкози в розчині, що містить 280 г води і 40 г глюкози. (12,5 %) 5. Визначте маси натрій тіосульфату Na2S2O3 та води, які необхідні для приготування 300 г розчину з масовою часткою натрій тіосульфату 5 %. (15 г; 285 г) 6. Визначте масову частку оцтової кислоти в розчині, який утвориться при змішуванні 120 г її розчину з масовою часткою 10 % та 40 г розчину з масовою часткою 90 %. (30 %) 7. Визначте молярну концентрацію, молярну концентрацію еквівалентів розчину натрій гідроксиду з масовою часткою 36 %, густина якого дорівнює 1,39 г/см3. (12,5 моль/л; 12,5 моль/л) 8. Обчисліть молярну концентрацію, молярну концентрацію еквівалентів і моляльність розчину сульфатної кислоти з масовою часткою Н2SO4 20 %, густина розчину 1,14 г/мл. (2,33 моль/л; 4,6 моль/л; 2,55 моль/кг) 9. Визначте молярну концентрацію, молярну концентрацію еквівалентів сульфатної кислоти з масовою часткою 96 %, густина розчину дорівнює 1,84 г/см3. (18 моль/л; 36 моль/л) 10. Знайдіть масу NaNO3, необхідну для приготування 300 мл розчину з концентрацією 0,2 моль/л. (5,1 г) 11. Скільки грамів Na2CO3 міститься в 500 мл розчину з концентрацією солі 0,25 н? (6,63 г) 12. У радіатор автомобіля налили 9 л води і 2 л метилового спирту (ρ = 0,8 г/мл). При якій найнижчій температурі можна залишати автомобіль на відкритому повітрі, не побоюючись, що вода в радіаторі замерзне? Ккр.(Н2О) = 1,86 К×г/моль. (» – 10 °С) 13. Обчисліть осмотичний тиск 1,5 л розчину, який містить 135 г глюкози C6H12O6 при 0 °С. (1,13 кПа.) 14. Обчисліть температуру кипіння розчину, який містить 2 г нафталіну C10H8 в 20 г ефіру, якщо температура кипіння ефіру 35,5 °C, а ебуліоскопічна константа 2,16. (37,28 °С) 15. При 315 К тиск насиченої пари над водою становить 8,2 кПа (61,5 мм рт. ст.). На скільки понизиться тиск пари при цій температурі, якщо в 540 г води розчинити 36 г глюкози C6H12O6? (54 Па) 16. Чому дорівнює осмотичний тиск 0,5 моль/лрозчину глюкози C6H12O6 при 25 °С? (1,24 МПа)
Для підготовки до наступної лабораторної роботи розв’язати задачу: Який об’єм концентрованої сульфатної кислоти (ρ = 1,84 г/см3) з масовою часткою 96 % необхідно взяти для приготування 500 мл розчину з молярною концентрацією еквівалентів 2 моль/л?
Лабораторна робота № 3 ПРИГОТУВАННЯ РОЗЧИНІВ. ВИЗНАЧЕННЯ КОНЦЕНТРАЦІЙ Мета роботи – набуття навичок приготування розчинів із сухої речовини або більш концентрованого розчину та визначенняконцентрації методом титрування. Теоретична частина. Розчин готується із наважки речовини або розбавленням концентрованого розчину. Для приготування розчину треба знати його концентрацію та скільки його потрібно. Ці величини лежать в основі розрахунків. Для переводу маси розчину в об’єм використовується відносна густина (ρ). Густину розчину можна визначити експериментально відносно води за допомогою ареометра. Інтерполяцією називають визначення значення функції, що знаходиться між виміряними її значеннями. Коли без великої похибки можна вважати, що функція у лінійно змінюється між двома сусідніми значеннями х, для інтерполяції використовують метод пропорційних частин. Функцію у, що відповідає даному значенню аргументу х, що лежить між двома табличними значеннями x1, у1 і х2, у2 обчислюють за формулою:
У загальному випадку варто скласти емпіричне рівняння у = f(x) за виміряним значенням у і по цьому рівнянню обчислити шукане значення у.
Приклад 1. Який об’єм з масовою часткою сульфатної кислоти 96 % (ρ = 1,84 г/мл) і яку масу води необхідно взяти для приготування 100 мл розчину з масовою часткою Н2SО4 15 % (ρ = 1,10 г/мл). Розв'язання 1) Визначаємо масу сульфатної кислоти:
2) Обчислимо об’єм розчину з масовою часткою сульфатної кислоти 96 %, який містить 16,5 г Н2SО4:
Приклад 2. Визначити об’єм розчину фосфатної кислоти з густиною 1,115 г/см3, який треба взяти для приготування розчину об’ємом ( Розв'язання 1) Визначаємо необхідну масу нітратної кислоти (m1): CE 2) З таблиці знаходимо у розчині масову частку нітратної кислоти, яка становить 20 %. Визначаємо необхідну масу розчину (mрозчину):
3) Знаходимо об’єм розчину:
Таким чином, для приготування 100 мл розчину фосфатної кислоти з молярною концентрацією еквівалентів 0,1 моль/л необхідно взяти 1,46 см3 розчину H3РO4 з густиною 1,115 г/см3 і добавити до 100 мл дистильованої води.
Експериментальна частина
|
|||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 260; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.007 с.) |

 ; х1 + х2 = 1.
; х1 + х2 = 1. 100 %;
100 %;  100 %.
100 %. . [моль/л], (скорочено М).
. [моль/л], (скорочено М).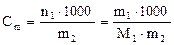 (моль/кг).
(моль/кг). (моль/л, або н),
(моль/л, або н),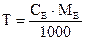 , г/мл
, г/мл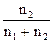
 ,
, 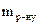 =
=  +
+ 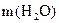 .
.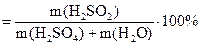 . Обчислюємо: ω
. Обчислюємо: ω 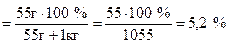 .
.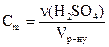 ;
;  ;
; ; звідси
; звідси  ;
;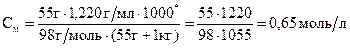 ;
; ;
;  в 1000
в 1000 
 .
. ;
; моль/л.
моль/л. ;
; 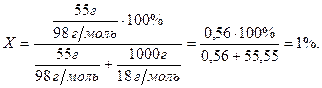

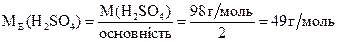 .
.
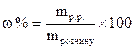 , де mрозчину = V · ρ,
, де mрозчину = V · ρ, 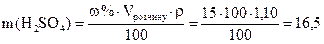 г
г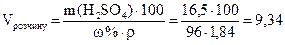 мл. Таким чином, для приготування 100 мл розчину з масовою часткою сульфатної кислоти 15 % необхідно 9,34 мл розчину з масовою часткою Н2SО4 96 % і 100 - 16,5 = 93,5 г води.
мл. Таким чином, для приготування 100 мл розчину з масовою часткою сульфатної кислоти 15 % необхідно 9,34 мл розчину з масовою часткою Н2SО4 96 % і 100 - 16,5 = 93,5 г води. ) 100 мл з молярною концентрацією еквівалентів 0,1 моль/л?
) 100 мл з молярною концентрацією еквівалентів 0,1 моль/л? => m1 =
=> m1 =  ;
; 
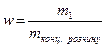 100 % =>
100 % => 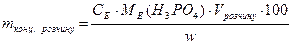 .
. = 1,46 см3.
= 1,46 см3.


