Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Квантово-механічна модель атомаСодержание книги
Поиск на нашем сайте
Підтверджена експериментально в 1927 р. двоїста природа електрона, що має властивості не тільки частки, але і хвилі, спонукала вчених до створення теорії будови атома, що враховує обоє ці властивості. Подвійність властивостей електрона виявляється в тім, що він, з одного боку, має властивості частки (має певну масу спокою), а з іншого боку – його рух нагадує хвилю і може бути описаний певною амплітудою, довжиною хвилі, частотою коливань і ін. Тому не можна говорити про яку-небудь визначену траєкторію руху електрона – можна лише судити про той чи інший ступінь імовірності його перебування в даній точці простору. Електронна орбіталь – не визначена лінія переміщення електрона, а деяка частина простору навколо ядра, у межах якого імовірність перебування електрона найбільша. Електронна орбіта не характеризує послідовність переміщення електрона від точки до точки, а визначається імовірністю перебування електрона на визначеній відстані від ядра. Електронна хмара не має різко обкреслених границь, і навіть на великій відстані від ядра існує імовірність перебування електрона. Стан електрона в атомі описується чотирма квантовими числами. 1. Головне квантове число n характеризує величину енергії електрона і може приймати тільки позитивні цілочислові значення: 1, 2, 3 і т. ін. Зі збільшенням головного квантового числа енергія електрона зростає. Стан електрона, що відповідає певному значенню головного квантового числа, називають енергетичним рівнем електрона в атомі. Крім енергії електрона головне квантове число визначає розміри електронної хмари: чим вище значення головного квантового числа, тим більше електронна хмара (е лектронний шар). Електронні шари позначають великими буквами латинського алфавіту K, L, M, N, O, причому K-шар є першим від ядра атома, йому відповідає головне квантове число n = 1, L-шар – другим, M-шар – третім і т.ін. Зі збільшенням головного квантового числа змінюються число і характер електронних орбіталей у межах даного електронного шару. Максимальна кількість електронів N у даному електронному шарі, описується формулою: N = 2n2. 2. Орбітальне квантове число l описує форму електронної хмари і може приймати будь-які цілочислове значення від 0 до (n – 1). Відповідні орбіталі позначаються малими літерами латинського алфавіту: s (l = 0), p (l = 1), d (l = 2), f (l = 3). Орбітальне квантове число відображає енергію електрона на підрівні. Електрони з різними орбітальними квантовими числами трохи відрізняються друг від друга: їхня енергія тим вище, чим більше число l. Число можливих підрівнів у кожному енергетичному рівні збігається з порядковим номером електронного шару, але фактично жоден енергетичний рівень не містить більше чотирьох підрівнів. Це справедливо для стаціонарного стану атомів всіх елементів. Так, першому енергетичному рівню відповідає s-підрівень; другому рівню – два підрівня: s і p; третьому рівню – три підрівня: s, p і d; четвертому і наступним – чотири підрівня: s, p, d і f. 3. Магнітне квантове число ml визначає орієнтацію орбіталей у просторі. Магнітне квантове число m може приймати цілочислові значення від – l до + l, у тому числі нульове значення. Воно визначає число орбіталей у електронному шарі: s-підрівень (m = 0), 3p-підрівень містить три орбіталі
ml = –1, 0, +1 d-підрівень містить п'ять орбіталей
ml = –2, –1, 0, +1, +2 f-підрівень містить сім орбіталей
ml = –3, –2, –1, 0, +1, +2, +3. Орбіталі з різними магнітними квантовими числами, але з однаковим головним і орбітальним квантовими числами, характеризуються однієї і тією же енергією. m –вектор, якому відповідає визначене числове значення і визначений напрямок, що виражається в знаках "+" і "–". 4. Спінове квантове число ms раніш зв'язували з обертанням електрона навколо своєї осі, але тепер його вважають чисто квантово-механічною величиною. Спін електрона може мати два значення: +½ і –½. Основні принципи розподілу електронів в атомі Електронна оболонка атома заповнюється електронами у відповідності правилам. 1. Принцип найменшої енергії: електрон в атомі займає той вільний підрівень, на якому він має мінімальне значення енергії. Тобто, електрон залишається на тім підрівні, на якому забезпечується найбільш міцний зв'язок з ядром. Послідовність заповнення підрівнів відповідає приведеному вище фактичному розташуванню підрівнів у структурі електронної оболонки атома: 1s→2s→2p→3s→3p→4s→3d →4р→5s→4d→5p→6s→4f→5d→6p→7s→5f→6d 2. Принцип Паулі: в атомі не може бути навіть двох електронів з однаковими значеннями чотирьох квантових чисел. На орбіталі може знаходитися два електрони з різними спінами (ms = +½ і ms = –½). Максимальне число електронів на підрівні визначають за формулою: К = 2 (2 l + 1). s2, p6, d10, f14.
У залежності від того, який підрівень заповнюється останніми електронами, розрізняють s-, p-, d-, f-елементи: s – елементи, в атомах яких останні електрони займають s-підрівень зовнішнього квантового рівня (Na, Mg, K, Ca); р – елементи, в атомах яких останні електрони займають р-підрівень зовнішнього квантового рівня (C, О, Cl, S); d – елементи, в атомах яких останні електрони займають d-підрівень (Тi, Cr, Fe, Cu); f-елементи, в атомах яких останні електрони займають f-підрівень другого від позаквантового рівня (Pr, Er, Eu). Теоретична послідовність розташування квантових рівнів і підрівнів виглядає так: 1s→2s→2p→3s→3p→3d→4s→4p→4d→4f→5s→5p→5d→5f→6s→6p→6d→6f→7s→7p→7d→7f 4. Правила Клечковського: 1. заповнення електронних шарів відбувається в порядку збільшення сум головного й орбітального квантових чисел (n + l). Так, сума (n + l) для електронів 3d-орбіталі дорівнює 5 (3 + 2), для електронів 4s-орбіталі – 4 (4 + 0). Тому спочатку електронами заповнюється 4s-орбіталь, а потім 3d-орбіталь. 2. Якщо для двох орбіталей суми (n + l) мають однакові значення, то спочатку електронами заповнюється орбіталь з меншим значенням головного квантового числа. Наприклад, для електронів 3d- і 4p-орбіталей сума n + l = 5 (відповідно 3 + 2 і 4 + 1). Але тому що для електронів 3d-орбіталі головне квантове число n = 3, а для електронів 4p-орбіталі n = 4, у першу чергу заповнюються 3d-орбіталі. Лише після того, як заповнені орбіталі менших енергій, починається заповнення орбіталей більших енергій. За правилом Клечковського послідовність розташування підрівнів наступна:
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→5d→4f→5d2–5→6p→7s→6d1→5f→ 6d2–5→7p Контрольні питання та вправи 1. Серед приведених електронних конфігурацій вказати неможливу та пояснити причину неможливості їх реалізації: а) 1s4; б) 3р5; в) 2p8; г) 6s1; д) 2d70; е) 6p6; ж) 2f7. 2. Який підрівень заповнюється у атомах після підрівня 2р; 4s; 5р; 4d; 5f; 6s? 3. Скільки неспарених електронів у незбудженого атому: а) Йоду (№ 53); б) Індію (№ 49); в) Фосфору (№ 15); г) Титану (№ 22)? 4. Запишіть електронну формулу атому з порядковим номером а) 35; б) 22; в) 17; г) 48; д) 66; є) 80; ж) 51; з) 88. 5. Вкажіть елемент, у якого електронна конфігурація зовнішнього рівня: а) 6s26p2; б) 4s24p5; в) 4s24p1; г) 3s23p3; д) 5s1; є) 5s25p6. 6. Запишіть електронну формулу атома Купруму. До якої родини елементів він належить? 7. Запишіть електронну формулу йонів: а) Mg2+; б) Fe2+; в) S2–; г) Br –; д) Ti 2+. 8. Назвіть елементи, яким відповідають такі електронні конфігурації: 1s2; 1s22s1; 1s22s22p1; 1s22s22p6; 1s22s22p63s23p63d14s2. 9. Складіть електронну формулу атома і графічну схему заповнення електронами валентних орбіталей цього атома в нормальному стані: Молібдену, Телуру, Стануму. 10. Зобразіть схематично будову атомів. У якого з елементів сильніше виражені металічні властивості? Поясніть. а) Sr i Ba; б) Rb i Sr; в) As i Bi; г) Tl i Pb; д) P i Cl. Лабораторна робота № 1
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.30.153 (0.008 с.) |

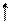 3. Правило Гунда (Хунда): у межах підрівня електрони розподіляються так, щоб сумарне квантове число мало максимальне значення (спочатку по одному електрону на орбіталь, а потім спарювання. Правильний розподіл 3р-електронів:
3. Правило Гунда (Хунда): у межах підрівня електрони розподіляються так, щоб сумарне квантове число мало максимальне значення (спочатку по одному електрону на орбіталь, а потім спарювання. Правильний розподіл 3р-електронів: