
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Засоби усування твердості водиСодержание книги
Поиск на нашем сайте
При тривалому використанні твердої води стінки парових котлів поступово вкриваються твердою кіркою накипу. Така кірка вже при товщині шару в 1 мм дуже знижує передавання тепла стінками котла і, отже, призводить до збільшення витрати палива. Крім того, вона може бути причиною утворення здуттів і тріщин в кип’ятильних трубах і на стінках самого котла. Тверда вода не дає піни з милом, бо розчинені натрієві солі жирних кислот – пальмітинової і стеаринової, які є в милі – переходять у нерозчинні кальцієві солі тих самих кислот:
Видалення солей, які зумовлюють твердість, називається водопом’якшенням, входить у систему водопідготовки – обробки природної води, яку використовують для живлення парових котлів і для різних технологічних процесів. Під час водопідготовки звільняються від грубодисперсних і колоїдних домішок і від розчинених речовин. Завислі і колоїдні домішки видаляють коагуляцією їх солями (звичайно Аl2(SО4)3 ), що додаються до води, з подальшою фільтрацією. Аl2(SО4)3 + ЗСа(НСО3)2 → 2Аl(ОН)3↓ + 3СаSо4 + 6СО2↑ При коагуляції в воді підвищується кількість сульфатів і вільної вугільної кислоти, але зменшується бікарбонатна лужність. Для водопом’якшення застосовують способи осадження і йонного обміну. Способом осадження катіони Са2+ і Мg2+ переводять у малорозчинні сполуки, що випадають в осад. Цього досягають фізичним методом – кип’ятінням: Са(НСО3)2 або хімічним методом – введенням у воду відповідних реагентів. Під час кип’ятіння зникає лише карбонатна твердість. При застосуванні хімічного методу найчастіше як осаджувач використовують вапно. При цьому відбуваються реакції: Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2H2О МgСl2 + Са(ОН)2 → Мg(ОН)2↓ + СаСl2 Якщо концентрація СаSО4 + СаСl2 складає більше 10 мг-екв/л, можна застосувати вапно-содову обробку води: СаSО4 + Nа2СОз → СаСО3↓ + Nа2SО4 СаСl2 + Nа2СОз → СаСО3↓ + 2NаСl Са(ОН)2 + Nа2СОз → СаСО3↓ + 2NаОН Щоб ліквідувати твердість методом йонного обміну або катіонування, воду пропускають через шар катіоніту. При цьому йони Са2+ і Мg2+, які є у воді, обмінюються на йони Nа+, що містяться у катіоні. У деяких випадках треба видалити з води не тільки йони Са2+ і Мg2+, а й інші йони. У таких випадках воду пропускають послідовно через катіоніт, що містить в обмінній формі гідроген-йони (Н-катіоніт), та аніоніт, що містить гідроксильні йони (ОH-аніоніт). В результаті вода звільнюється від катіонів та аніонів солей. Така обробка називається знесолюванням води. Приклад реакції катіонного обміну (R – означає смолу): 2R‾ – Nа+ + Са2+(НС Для аніонного обміну широко застосовується високоосновна смола в хлоридній формі: R+Cl‾ + Nа+N Таким чином звільняють воду від нітратів. Коли процес йонного обміну доходить до рівноваги, йоніт перестає працювати – втрачає здатність пом’якшувати воду. Але будь-який йоніт легко зазнає регенерації. Для цього через катіоніт пропускають концентрований розчин NаСl (Nа2SO4) або НС1 (Н2SO4). При цьому йони Са2+ і Мg2+ переходять у розчин, а катіоніт знову насичується йонами Nа+ або H +. Для регенерації аніоніту його обробляють розчинами лугу або соди (цей розчин, внаслідок гідролізу карбонатного йону, також має лужну реакцію). В результаті поглинуті аніони витісняються в розчин, а аніоніт знову насичується йонами ОН–. 3. ВИЗНАЧЕННЯ ТВЕРДОСТІ ВОДИ Для визначення загальної твердості води застосовують метод комплексонометричного титрування, заснований на використанні реакцій, які супроводжуються утворенням комплексних сполук катіонів з комплексонами. Комплексони є похідними амінополікарбонових кислот, серед яких найбільше практичне значення має етилендіамінтетраоцтова кислота. На практиці звичайно застосовують двозаміщену натрієву сіль цієї кислоти (ЕДТА), що відома також під назвами комплексон III або трилон Б. Структурна формула ЕДТА має вид:
Комплексон III утворює внутрікомплексні солі із йонами металів (йонами твердості) шляхом заміщення атомів Гідрогену карбоксильних груп, а також утворенням координаційного зв'язку з атомом Нітрогену:
Me
Комплекси, які утворюються комплексонами з катіонами металів, досить стійкі і мають рКнест від 8 до 26 (для ЕДТА), що забезпечує практично повне зв'язування металу, що визначають, у комплекс. Як індикатори застосовують органічні барвники, які утворюють з йонами металів (йонами твердості) теж комплексні сполуки, але менш стійкі. Забарвлення комплексної сполуки індикатора відрізняється від забарвлення вільного індикатора. Тому в процесі титрування комплексна сполука індикатора з катіоном металу руйнується й індикатор виділяється у вільному виді, при цьому відбувається зміна забарвлення титрованого розчину в точці еквівалентності. У даній роботі використовується як індикатор барвник еріохром чорний Т, який має синє забарвлення у лужному середовищі, а його комплекс з йонами твердості – червоне забарвлення. Якщо у воду внести барвник, то розчин забарвиться у червоний колір, а під час титрування розчином комплексона ІІІ у точці еквівалентності – у синій, тому що утвориться інший, безбарвний, комплекс, і індикатор перейде у вільну форму. Визначення буде правильним, якщо розчин має рН 10. З цією метою у воду додають амоніачний буферний розчин з рН 10. Для визначення КАРБОНАТНОЇ ТВЕРДОСТІ можна використати метод титрування певного об'єму води розчином хлоридної кислоти відомої концентрації в присутності індикатора метилового оранжевого. ПОСТІЙНУ ТВЕРДІСТЬ води розраховують по різниці між загальною й карбонатною твердістю. ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ Прилади і реактиви. Бюретки місткістю 25 мл. Піпетки місткістю 100 і 50 мл. Конічні колби місткістю 250 мл. Лійки для бюреток. Індикатори: метиловий оранжевий. Еріохром чорний Т (0,2 %-ий розчин у спирті). Розчини: хлоридної кислоти (0,1 н., титрований); буферний розчин (20 г хч амоній хлориду розчинити в дистильованій воді, додати 100 мл 25 %-ого розчину амоніаку і дистильованої води до мітки в мірній колбі місткістю 1 л); ЕДТА (0,02 н., титрований; 3,7224 г ЕДТА розчинити в мірній колбі місткістю 1 л у дистильованій воді, розчин довести до мітки). Вода для аналізування. а) Визначення тимчасової твердості Тому що вода, що містить гідрокарбонати кальцію і магнію, має лужну реакцію (чому?), визначення карбонатної твердості виконується безпосереднім титруванням води хлоридною кислотою в присутності індикатора – метилового оранжевого. Хід роботи. Відміряти піпеткою зазначений викладачем об’єм досліджуваної води (100 – 50 мл) і перенести її в конічну колбу для титрування. Додати 2 – 3 краплі індикатора метилового оранжевого. У приготовлену заздалегідь бюретку налити 0,1 моль/л титрований розчин хлоридної кислоти. Установити рівень на нульовій поділці і по краплях доливати хлоридну кислоту у воду до зміни забарвлення розчину від жовтого до оранжево-рожевого. Визначити об’єм витраченої на титрування хлоридної кислоти і записати його в таблицю. Титрування повторити ще два рази, щораз доливаючи в бюретку кислоти до нульової поділки й обполіскуючи колбочку для титрування. Розбіжність в об’ємі кислоти при титруванні не повинна перевищувати 0,05 мл. Результати досліду записати в таблицю:
Тимчасову твердість води (у ммоль екв/л) розраховують по формулі:
СHCl VHCl ∙1000 VН2О
б) Визначення загальної твердості Заповнити бюретку титрованим розчином ЕДТА (0,1 моль/л). Відміряти піпеткою зазначений викладачем об’єм аналізованої води і перенести її в конічну колбу для титрування. Долити дистильованої води до загального об’єму 100 мл (воду відміряти мензуркою). Додати 5 мл буферного розчину (NH3 + Н2О + NH4Cl) для підтримки рН в інтервалі 9 – 10 і 2 – 3 краплі індикатора – еріохрому чорного, при якому розчин забарвиться в червоний колір. Перемішати розчин і відразу титрувати з бюретки розчином ЕДТА до переходу червоного забарвлення в синє. Титрування повторити три рази, як у досліді а. Результати записати в таблицю.
Загальну твердість води (у мекв/л) розраховують за формулою: С ЕДТА∙VЕДТА ∙1000 V Н2О в) Визначення постійної твердості води Постійна твердість води обчислюється за різницею загальної і тимчасової твердості:
До якого типу твердості відноситься досліджена вода? Контрольні питання і задачі 1. Що таке тимчасова і постійна твердість? В яких одиницях вона вимірюється? 2. Які незручності зв’язані із застосуванням твердої води в тепловому господарстві? 3. Обчисліть твердість води, якщо на її усунення пішло 265 г натрій карбонату у розрахунку на 1 м3 води. 4. Зразок води об’ємом 1 л містить 48,6 мг гідрокарбонату кальцію і 29,6 мг сульфату магнію. Яка кількість Са2+ і Mg2+ міститься в 1 л зразка води? Чому дорівнює загальна твердість води? 5. Чому дорівнює твердість (у ммоль/л) СаС12 0,005 моль/л? 6. На титрування 0,05 л зразка води витрачено 4,8 ∙ 10–3 л розчину з молярною концентрацією НСl 0,1 моль/л. Чому дорівнює карбонатна твердість води? 7. При визначенні тимчасової твердості на титрування 0,1 л води витрачено 5,25 ∙ 10–3 л розчину з молярною концентрацією НСl 0,101 моль/л. Чому дорівнює тимчасова твердість води? 8. Яку масу гашеного вапна треба додати в 2,5 л води, щоб усунути її тимчасову твердість, яка дорівнює 4,43 ммоль/л? Лабораторна робота № 13 ВЛАСТИВОСТІ ЕЛЕМЕНТІВ І ЇХ СПОЛУК (НЕМЕТАЛИ)
Відмінною рисою всіх неметалічних елементів є здатність їхніх атомів приєднувати електрони. У періодичній системі елементів неметали розташовані в головних підгрупах IV-VII груп. Активність неметалів, тобто схильність до приєднання електронів у групах періодичної системи збільшується знизу вгору, а в періодах - зліва направо. Кількісно активність неметалів може бути охарактеризована величиною спорідненості до електрона (або електронегативності) і стандартним окисно-відновним потенціалом. Перша із зазначених величин характеризує процес приєднання електронів у газовій фазі, друга відноситься до процесу перетворення атома неметалу в сольватований аніон за участю молекул розчинника.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 143; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.194.225 (0.01 с.) |

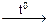 СаСО3↓ + СО2↑ + Н2О
СаСО3↓ + СО2↑ + Н2О )2 → (R‾)2Сa2+ + 2Nа+НСО3–
)2 → (R‾)2Сa2+ + 2Nа+НСО3– HOOCH2C CH2COONa
HOOCH2C CH2COONa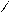
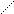 N–CH2–CH2–N
N–CH2–CH2–N HOOCH2C CH2COOH
HOOCH2C CH2COOH
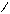
 OOCH2C CH2COONa
OOCH2C CH2COONa
 N–CH2–CH2–N
N–CH2–CH2–N NaOOCH2C CH2COO
NaOOCH2C CH2COO


