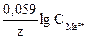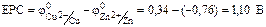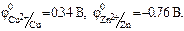Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакції в розчинах електролітів. Умови утворення осадуСодержание книги
Поиск на нашем сайте
Теоретична частина. Електроліти – речовини, що здатні до розпаду на йони в розчинах чи в розплавленому стані. Електролітична дисоціація – процес розпаду молекул на позитивно і негативно заряджені йони під дією полярних молекул розчинника. Кількісною характеристикою сили електроліту є ступінь електролітичної дисоціації (a) – відношення числа молекул, що розпалися на йони (n), до загального числа молекул, введених у розчин (N): a = n/N; 0 < a < 1. a залежить від природи електроліту і розчинника, температури і концентрації. Сильні електроліти практично цілком розпадаються на йони (a>0,3). Слабкі електроліти частково дисоційовані на йони ( 0 < a < 0,03), їх розчини містять йони і недисоційовані молекули. Неелектроліти – речовини, водні розчини і розплави яких не проводять електричний струм. Вони містять ковалентні неполярні чи малополярні зв'язки. Константа дисоціації (KD) – відношення добутку рівноважних концентрацій йонів у ступені відповідних стехіометричних коефіцієнтів до концентрації недисоційованих молекул. Вона є константою рівноваги процесу електролітичної дисоціації; характеризує здатність речовини розпадатися на йони: чим вище KD, тим більше концентрація йонів у розчині.
Реакції йонного обміну – це реакції між йонами, що утворилися в результаті дисоціації електролітів. Якщо в розчині немає йонів, що можуть зв'язуватися між собою з утворенням осаду, газу, малодисоційованих сполук чи комплексних йонів, реакції обміну оборотні. Добуток концентрацій йонів у насиченому розчині важкорозчинного електроліту при постійній температурі є постійноювеличиною і називається добутком розчинності (ДР). Для електроліту AmBn вираз добутку розчинності має вигляд: ДР(AmBn) = с m (A+) · с n (B–). Наприклад, ДР(Ag2S) = с2 (Ag+) · с(S2–). Осад утвориться в тому випадку, коли добуток концентрацій йонів малорозчинного електроліту перевищить величину його добутку розчинності при даній температурі. Дослід 1. Порівняння електропровідності розчинів деяких речовин
Досліджуваний розчин налити в склянку до нижньої мітки й опустити в розчин електроди. Уставити вилку електродів у розетку (U = 36 B) і відзначити показання амперметра. Після вимірювань розчин перелити в ту ж пляшку, а електроди вимити, помістивши їх спочатку в склянку з водопровідною, а потім у склянку з дистильованою водою. Отримані дані записати на дошці, а потім згрупувати електроліти по силі (заповнити таблицю 9 із зазначенням сили струму I). Сильними вважати електроліти, у яких I = 0,5 А, слабкими – 0,05 А. Таблиця 9
Для всіх електролітів записати рівняння електролітичної дисоціації. _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________ б) Злити розчини ацетатної кислоти й амоніаку, випробувати електропровідність отриманого розчину. Відзначити спостереження, скласти молекулярне та скорочено-йонне рівняння реакції та рівняння електролітичної дисоціації. _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________ Дослід 2. Зсув рівноваги дисоціації слабких електролітів. Налити в пробірку розчин амоніаку, додати 1-2 краплі фенолфталеїну, перемішати вміст пробірки і розділити його на дві частини. В одну з пробірок додати кристалічний амоній хлорид. Порівняти забарвлення розчину в обох пробірках. Зробити висновки, використовуючи принцип Ле-Шательє. __________________________________________________________________________________________________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________ Дослід 3.Йонні реакції. а) З утворенням слабкого електроліту. Покладіть в пробірку небагато кристалічного амоній хлориду і додайте розчин натрій гідроксиду. Визначте газ, що виділяється, за запахом, ледь-ледь підігрівши пробірку. Складіть молекулярне та йонні рівняння реакції. б) З утворенням осаду. Налийте в три пробірки по 2-3 краплі розчину барій хлориду і додайте: в першу – розчин натрій сульфату, в другу – сульфатну кислоту, в третю – розчин алюміній сульфату. Що спостерігаєте? Складіть молекулярні та йонні рівняння реакції.
Дослід 4. Утворення осадів і добуток розчинності. У дві пробірки налийте по 3 - 4 краплі розчину з молярною концентрацією плюмбум (ІІ) нітрату 0,005 моль/л. В одну додайте такий же об’єм 0,05 моль/л розчину калій хлориду, а в іншу – такий же об’єм розчину 0,05 моль/л розчину калій йодиду. В якій із пробірок випав осад? Поясніть, використовуючи значення добутку розчинності (ДР(РbI2) = 8,0 · 10–9, ДР(РbCl2) = 1,7· 10–5). Складіть рівняння реакцій.
Контрольні питання і задачі 1. Які речовининазиваються електролітами? Назвіть типи електролітів та наведіть приклади. 2. Який процес називається електролітичною дисоціацією? 3. На що вказує ступінь дисоціації? Як обчислити константу дисоціації? 4. Дайте визначення з точки зору теорії електролітичної дисоціації поняттям "кислоти, основи, солі". 5. Що таке основність кислоти, кислотність основи? Напишіть рівняння дисоціації двохосновної кислоти та двохкислотної основи. 6. Константа дисоціації масляної кислоти С3Н7СООН 1,5 ∙ 10–5. Обчисліть ступінь її дисоціації в 0,005 моль/л розчині. (0,055) 7. Обчисліть об’єм води, який треба додати до 300 мл 0,2 моль/л розчину оцтової кислоти, щоб ступінь дисоціації кислоти подвоїлася? (900 мл). 8. До 50 мл розчину з молярної концентрацією еквівалентів хлоридної кислоти 0,001 моль/л додали 450 мл розчину з молярною концентрацією еквівалентів аргентум нітрату 0,0001 моль/л. Чи випаде осад аргентум хлориду? (так). 9. Напишіть в йонно-молекулярній формі рівняння реакцій взаємодії між водними розчинами наступних речовин: а) NaHCO3 і HCl, б) FeCl3 і KOH, в) Pb(CH3COO)2 і Na2S, г) KHS і H2SO4, д) Zn(NO3)2 + KOH (надлишок), e) Ca(OH)2 + CO2, ж) Ca(OH)2 + CO2 (надлишок). Для кожного випадку вказати причину зсуву рівноваги убік прямої реакції. 10. Чи утвориться осад аргентум сульфату, якщо до 0,02 моль/лрозчину AgNO3 додати такий же об’єм розчину з молярною концентрацією еквівалентів H2SO4 1 моль/л? (так). 11. Обчисліть ступінь дисоціації гіпохлоритної кислоти НОСl у розчині з молярною концентрацією еквівалентів 0,2 моль/л.(5 ·10–4). Лабораторна робота № 5 РН. ГІДРОЛІЗ СОЛЕЙ Теоретична частина. Величина pН використовується для характеристики кислотності розчину. Якщо концентрація йонів Гідрогену С(H+), то pН = –lg С(H+). У кислих розчинах: С(H+) > C(ОН–) і pН < 7 У лужних розчинах: С(H+) < C(ОН–) і pН > 7 У чистій воді: С(H+) = С(OH–) = 10–7. Наряду з показником рН використовують показник рОН: рОН = -lg C(ОН–). Добуток концентрації йонів Гідрогену й гідроксид-йонів при постійній температурі є величиною сталою. Ця величина називається йонним добутком води (КН2О) і при 22˚C дорівнює: КН2О = СН+ · СОН¯ = 10-14 Виходячи із йонного добутку води рН + рОН = 14.
Гідроліз – хімічна реакція йонного обміну між водою і розчиненою у ній речовиною з утворенням слабкого електроліту. Гідроліз супроводжується зміною pН розчину. Причиною гідролізу є взаємодія йонів солі з молекулами води з утворенням малодисоційованих сполук чи йонів. Солі, утворені катіоном сильної основи й аніоном сильної кислоти (наприклад, LiBr, K2SO4, NaCl, BaCl2, Ca(NO3)2), гідролізу не піддаються, тому що ні катіон, ні аніон солі не можуть при взаємодії з водою утворити молекули слабких електролітів (pН = 7). Солі слабкої основи і сильної кислоти гідролізуються по катіону: NH4Cl +H2O=NH4OH + HCl NH4+ + H2O = NH4OH + H+ (pН < 7) Гідроліз солей, утворених багатовалентним катіоном, протікає ступінчасто через стадії утворення основних солей: 1 ступінь: Al(NO3)3 + H2O = Al(OH)(NO3)2 + HNO3 Al3+ + H2O = [Al(OH)]2+ + H+ 2 ступінь: Al(OH)(NO3)2 + H2O = Al(OH)2(NO3) + HNO3 [Al(OH)]2+ + H2O = [Al(OH)2]+ + H+ 3 ступінь: Al(OH)2(NO3) + H2O = Al(OH)3 + HNO3 [Al(OH)2]+ + H2O = Al(OH)3 + H+ Солі, утворені сильною основою і слабкою кислотою, гідролізуються по аніону: CH3COOK + H2O = CH3COOH + KOH CH3COO– + H2O = CH3COOH +OH– (pН > 7). Солі багатоосновних кислот гідролізуються ступінчасто (з утворенням кислих солей): 1 ступінь: K2CO3 + H2O = KHCO3 + KOH (швидко) CO2–3 + H2O = HCO3– + OH– 2 ступінь: KHCO3 + H2O = H2CO3+ KOH (слабко) HCO3– + H2O = H2CO3 + OH– Солі, що утворені слабкою основою і слабкою кислотою, гідролізуються по катіону і по аніону: CH3COONH4 + H2O = CH3COOH + NH4OH CH3COO– + NH4+ + H2O = CH3COOH + NH4OH Гідроліз таких солей протікає сильно, оскільки в результаті його утворюються слабка основа і слабка кислота. рН у цьому випадку залежить від порівняльної сили основи і кислоти. Якщо KD(основи)>KD(кислоти), то pН>7; якщо KD(основи) < KD(кислоти), то pН < 7. У випадку гідролізу CH3COONH4: KD(NH4OH) = 6,3 · 10–5; KD(CH3COOH) = 1,8 · 10–5, тому реакція водного розчину цієї солі буде слаболужною, майже нейтральною (pН = 7 - 8). Якщо основа і кислота, що утворюють сіль, є малорозчинні чи нестійкі і розкладаються з утворенням летких продуктів, то в цьому випадку гідроліз солі протікає необоротно: Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑. Тому сульфід алюмінію не може існувати у виді водних розчинів, може бути отриманий тільки "сухим способом". Ступінь гідролізу (aгідр.) – відношення числа гідролізованих молекул до загальної кількості розчинених молекул (виражається у відсотках): aгідр. = (Cгідр./Cрозч.) · 100 % Ступінь гідролізу залежить від хімічної природи кислоти (основи), що утвориться при гідролізі, і буде тим більше, чим слабкіша кислота (основа). Таблиця 10
Дослід 1. Забарвлення індикаторів у різних середовищах. В 3 пробірки налийте хлоридну кислоту, в 3 інші – розчин натрій гідроксиду і в 3 – дистильовану воду. Згрупуйте пробірки по 3 так, щоб в групі були лужний, кислий і нейтральний розчини. В першу групу пробірок додайте фенолфталеїн, в другу – лакмус, в третю – метилоранж. Результати досліду запишіть в таблицю 11 Таблиця 11
Дослід 2. Гідроліз солей а) Залежність характеру середовища розчинів від природи солей. У п'ять пробірок налийте по 1 мл дистильованої води і додайте лакмус. Внесіть у першу пробірку натрій карбонат, у другу – алюміній сульфат, у третю – натрій сульфат, у четверту – натрій ортофосфат. П'ята пробірка служить для порівняння отриманих кольорів. Які з випробуваних солей піддалися гідролізу? Складіть рівняння реакцій гідролізу.
б) Вплив сили кислоти і основи, що утворюють сіль, на ступінь гідролізу. В дві пробірки налийте по 0,5 мл розчинів Na2SO3 і Na2СO3 з молярною концентрацією еквівалентів 1 моль/л, додайте в кожну з них по 1-2 краплі фенолфталеїну. Порівняйте інтенсивність забарвлення індикатора в обох пробірках. Яка з солей гідролізується в більшій мірі? Відповідь мотивуйте, порівнявши силу кислот Н2SO3 і Н2СO3 (табл.10).
в) Взаємне посилення гідролізу солі слабкої основи сіллю слабкої кислоти. Налийте в пробірку 5-6 крапель розчину алюміній сульфату і додайте такий же об’єм розчину натрій карбонату. Порівняйте спостереження з дослідом 2а. Відзначте виділення бульбашків газу (якого?) і утворення осаду (якого?) та характер середовища. Напишіть молекулярне і йонно-молекулярне рівняння гідролізу солі.
Контрольні питання і задачі
1. Яка величина є кількісною характеристикою кислотності середовища? 2. Обчислити рН розчину з молярною концентрацією оцтової кислоти 0,01 моль/л, в якому ступінь її дисоціації дорівнює 0,042. 3. Які з перерахованих нижче солей піддаються гідролізу: ZnBr2, K2S, Fe2(SO4)3, MgSO4, Cr(NO3)3, K2CO3, Na3PO4, CuCl2. Для кожної з солей, що гідролізується, напишіть в молекулярній та йонно-молекулярній формі рівняння гідролізу по кожному ступеню, вкажіть реакцію середовища розчину солі. 4. У який колір буде забарвлений лакмус у водних розчинах KCN, NH4Cl, K2SO3, NaNO3, FeCl3, Na2CO3, Na2SO4? Відповідь поясніть. 5. Обчисліть рН розчинів, у яких концентрація йонів Н+ (моль/л) дорівнює: а) 4,6 · 10–7; б) 8,1 · 10–3; в) 2,7· 10–10 (а) 6,70, б) 2,09, в) 9,57). 6. Обчисліть молярну концентрацію йонів Н+ у водних розчинах, якщо концентрація гідроксид-йонів складає: а)10–4; б)3,2·10–6; в)7,4·10–11. (а) 10–10 моль/л, б) 3,12·10–9 моль/л, в) 1,35·10–4 моль/л).
Лабораторна робота № 6 ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Теоретична частина. Окисно-відновні реакції характеризуються переходом електронів від одного компонента реакції до іншого. Окиснення – це віддача електронів атомами, йонами або молекулами, внаслідок чого ступінь окиснення елементів, що втратили електрони, зростає:
Відновлення – процес приєднання електронів атомами, йонами або молекулами, внаслідок чого ступінь окиснення елементів, що приєднали електрони, зменшується:
Речовини, що в окисно-відновних реакціях втрачають електрони, називаються відновниками, а речовини, що приєднують електрони, – окисниками. Ступінь окиснення – це умовний заряд атома в молекулі, обчислений у припущенні, що молекула складається з йонів і в цілому електронейтральна (у ряді випадків ступінь окиснення не збігається з валентністю). Вплив середовища на перебіг реакції:
Дослід №1. У 3 пробірки налийте по 1 краплі розчину калій перманганату КМnО4. У першу пробірку додайте 2 – 3 краплі розчину сульфатної кислоти, у другу – дистильованої води, у третю – 4 краплі розчину натрій гідроксиду. В усі пробірки додайте розчин натрій сульфіту. Опишіть спостереження в ході реакцій. Складіть рівняння реакцій і зрівняйте методом електронного балансу.
1____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ 2. ___________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________ 3.___________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________
Дослід № 2. До 2 крапель розчину калій йодиду КI долити 2 краплі розчину сульфатної кислоти Н2SО4 і 2 краплі розчину калій йодату КIО3. Описати спостереження в ході реакції. Скласти рівняння реакції і зрівняти методом електронного балансу. Довести наявність вільного йоду за взаємодією з крохмалем. _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ Дослід № 3. До 2 крапель біхромату калію К2Сr2О7 додати 2 краплі розведеної сульфатної кислоти і 2 краплі розчину калій нітриту КNO2. Описати спостереження в ході реакції. Скласти рівняння реакції і зрівняти методом електронного балансу. _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ Контрольні питання та вправи 1. Які реакції називаються окисно-відновними? 2. Вкажіть типи окисно-відновних реакцій. 3. Які речовини в окисно-відновних реакціях називаються відновниками, а які – окисниками? 4. Визначте ступінь окиснення Сr в наступних сполуках: К2СrО4, Сr2О3, Fе(СrО2)2, К2Сr2О7, Сr2(SО4)3 5. Укажіть, які з приведених процесів являють собою окиснення, а які – відновлення: S → SO42–; S → S 2–; Sn → Sn 4+; К → К +; Вr2 → 2Вr–; 2Н+ → Н2; Н2 → 2Н–; СI – → СIО3–; V2+ → VO3–; IО3– → I2; МnО4 – → МnО4 2–. 6. Які з приведених реакцій відносяться до реакцій міжмолекулярного окиснення-відновлення, до реакцій внутрімолекулярного окиснення-відновлення і до реакцій диспропорціонування? а) 4 КМnО4 + 4 КОН = 4 К2МnО4 + О2 + 2 Н2О; б) Н2SО4 + 2 Н2S = 3 S + 3 Н2О; в) NН4NО2 = N2 + 3 Н2О; д) 2 Н2О2 = О2 + 2 Н2О; г) 4 Р + 3 КОН + 3 Н2О = РН3 + 3 КН2РО2; е) 2 КМnО4 + 3 МnSО4 + 4 Н2О = 5 МnО2 + К2SО4+ 2Н2SО4. 7. Методом електронного балансу зрівняйте рівняння реакцій: 1) As + HNO3 + H2O ® H3AsO3 + NO 2) KI + KNO2 + H2SO4 ® I2 + NO + K2SO4 + H2O 3) Sb + HNO3 + HCl ® SbCl3 + NO + H2O 4) C + K2Cr2O7 + H2SO4 ® CO2 + Cr2(SO4)3 + K2SO4 + H2O 5) H2S + K2Cr2O7 + H2SO4 ® S + Cr2(SO4)3 + K2SO4 + H2O 6) SnSO4 + K2Cr2O7 + H2SO4 ® Sn(SO4)2 + Cr2(SO4)3 + K2SO4 + H2O 7) PH3 + KMnO4 + H2SO4 ® H3PO4 + MnSO4 + K2SO4 + H2O 8) HNO2 + KMnO4 + H2SO4 ® HNO3 + MnSO4 + K2SO4 + H2O 9) MnO2 + KClO3 + KOH ® K2MnO4 + KCl + H2O 10) Al + KClO4 + H2SO4 ® Al2 (SO4)3 + KCl + H2O 11) CrCl3 + Br2 + KOH ® K2CrO4 + KBr + KCl + H2O 12) Cr(OH)3 + Br2 + NaOH ® Na2CrO4 + NaBr + H2O 13) Cr(NO3)3 + Br2 + KOH ® K2CrO4 + KBr + KNO3 + H2O 14) Al + NaOH + H2O ® NaAlO2 + H2 15) HgS + HNO3 + HCl ® S + HgCl2 + NO + H2O 16) Fe + KNO3 ® Fe2O3 + N2 + K2O 17) Na2SO3 + KMnO 18) Na2SO3 + KMnO4 + KOH ® Na2SO4 + K2MnO4 + H2O 19) FeSO4 + KMnO4 + KOH ® Fe(OH)3¯ + K2MnO4 + K2SO4 20) FeS2 + HNO3(конц.) ® Fe(NO3)3 + H2SO4 + NO2 21) FeCl2 + H2SO4 ® FeCl3 + SO2 + FeSO4 + H2O 22) KI + HNO3 ® I2 + KNO3 + NO + H2O 23) CuS + HNO3 ® CuSO4 + NO2 + H2O 24) SO2 + KMnO4 + H2O ® H2SO4 + K2SO4 + MnSO4 25) KMnO4 + HCl ® Cl2 + MnCl2 + KCl +H2O Лабораторна робота № 7 ГАЛЬВАНІЧНІ ЕЛЕМЕНТИ
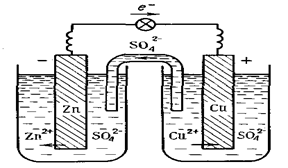
Теоретична частина. У гальванічних елементах окисно-відновні реакції протікають на поверхні електродів. Процеси окиснення і відновлення просторово розділені. Окиснення протікає на аноді, відновлення – на катоді. У гальванічному елементі анодом є електрод, потенціал якого менший, ніж потенціал катода. Анод має заряд “–“, катод – заряд “+”. Величина електродного потенціалу для металічних електродів залежить від природи металу, концентрації його йонів у розчині електроліту та температури і обчислюється за рівнянням Нернста: При Т = 298 К рівняння Нернста має вигляд: j = j0+ Гальванічний елемент – пристрій, в якому хімічна енергія окисно-відновної реакції перетворюється на електричну. Гальванічний елемент складається із двох електродів – анода і катода, занурених у розчин або розплав електроліту, електролітичного ключа (сольовий місток) і зовнішньої схеми (металічні провідники та вимірювач напруги чи сили струму). Електрорушійна сила (ЕРС) процесу для гальванічного елементу визначається як різниця між потенціалами катода Ек і анода Еа: ЕРС = jк – jа. Прикладом гальванічного елемента є мідно-цинковий елемент Данієля-Якобі, що складається з цинкової та мідної пластинок, занурених в розчини цинк і купрум (ІІ) сульфатів з молярними концентраціями 1 моль/л (рис. 1). Цинковий електрод є анодом, на якому проходить окиснення цинку: Zno = Zn2+ + 2ē. Мідний електрод – катод, на якому проходить відновлення йонів міді з розчину: Cu2+ + 2ē = Cuo Сумарне рівняння процесу в йонному вигляді: Zno + Cu2+ = Cuo + Zn2+, або в молекулярній формі: Zn + CuSO4 = Cu + ZnSO4 Схематичний запис гальванічного елемента: (–) Zn| ZnSO4 || CuSO4| Cu (+). За стандартних умов ЕРС гальванічного елемента:
Рис. 2. Схема гальванічного елемента Данієля-Якобі
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 211; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.35.129 (0.012 с.) |

 а) На кожен стіл виділяється по 2 – 3 розчини (пляшки з позначкою " для дисоціації "). Розчини, що рекомендуються: HCl, H2SO4, CH3COOH, NaOH, NH4OH, NaCl, KNO3, глюкоза, цукор, гліцерин, спирт.
а) На кожен стіл виділяється по 2 – 3 розчини (пляшки з позначкою " для дисоціації "). Розчини, що рекомендуються: HCl, H2SO4, CH3COOH, NaOH, NH4OH, NaCl, KNO3, глюкоза, цукор, гліцерин, спирт.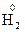 – 2ē ® 2
– 2ē ® 2 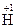 ;
; 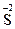 – 2ē ®
– 2ē ® 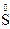 ;
; 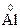 – 3ē ®
– 3ē ® 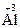 ;
; 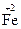 – ē ®
– ē ® 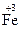 ; 2
; 2 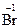 – 2ē ® Br20.
– 2ē ® Br20.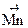 + 2ē ®
+ 2ē ® 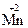 ;
; 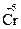 +3ē ®
+3ē ® 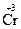 ;
; 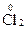 +2ē ® 2
+2ē ® 2 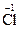 ;
; 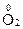 + 4ē ® 2
+ 4ē ® 2 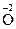 .
.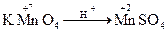
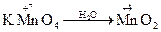
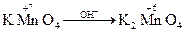
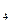 + K2SO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O
+ K2SO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O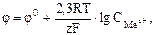 де j0 – стандартний електродний потенціал; R – універсальна газова стала, R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F – стала Фарадея, F = 96500 Кл/моль; CМеz+ - концентрація йонів металу в розчині, моль/л.
де j0 – стандартний електродний потенціал; R – універсальна газова стала, R = 8,314 Дж/(К·моль); T – абсолютна температура, К; z – заряд йону металу; F – стала Фарадея, F = 96500 Кл/моль; CМеz+ - концентрація йонів металу в розчині, моль/л.