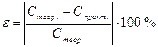Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення концентрації розчиненої речовини методом титруванняСодержание книги
Поиск на нашем сайте
Теоретична частина. Метод титрування полягає в тому, що проводиться реакція між двома розчинами, концентрація одного з них відома, а другого – невідома. Між реагуючими розчинами діє закон еквівалентів – їх об'єми в реакції зворотно пропорційні молярним концентраціям еквівалентів: V1: V2 = CЕ(2): СЕ(1), або V1 · CЕ(1) = V2 · CЕ(2) Якщо реакція супроводжується зовнішніми змінами – зміною кольору, випаданням осаду, то точку еквівалентності (кінець реакції) визначають за цими показниками. Коли змін немає, то реакцію ведуть в присутності індикаторів. Титрування – повільне ведення реакції під контролем зовнішніх показників, коли до заданого об'єму розчину з невідомою концентрацією краплинами додається розчин відомої концентрації, об'єм першого розчину задається хімічною піпеткою, об'єм другого розчину відмічається по бюретці. Титрування ведеться в спеціальних конічних колбах, зручних для перемішування розчинів і проводиться тричі. В розрахунок слід брати середній об'єм розчину, який використовувався для титрування. Правильним вважається таке титрування, коли результати виміру об'єму не відрізняються більш, ніж на 0,1 мл.
Хід роботи. Визначте молярну концентрацію еквівалентів кислоти методом титрування його лугом. Заповніть бюретку розчином з молярною концентрацією еквівалентів NaOH 1 моль/л, встановіть рівень розчину на нульовій поділці по нижньому меніску. Виберіть піпетку для розчину кислоти, промийте її дистильованою водою та розчином, який буде вимірюватися. Відміряйте 5 мл розчину кислоти (піпетку занурте обов'язково до дна) і перенесіть його в колбу для титрування. Додайте 1-2 краплини розчину фенолфталеїну і титруйте лугом з бюретки до появи блідо-рожевого забарвлення. Визначте об’єм витраченого лугу з точністю до 0,1 мл. Титрування проведіть тричі і його результати запишіть в таблицю. Перед кожним титруванням колбочку для кислоти ополосніть дистильованою водою, а рівень лугу в бюретці доведіть до нуля. Результати титрування запишіть в табл. 6. Таблиця 6
Обчисліть молярну концентрацію еквівалентів кислоти за формулою: Обчисліть відносну похибку досліду за формулою: _____________________________________________________________________________________ Висновок: __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Контрольні питання і задачі 1. До якого об’єму треба розбавити розчин НСl об’ємом 25 мл з молярною концентрацією 6 моль/л, щоб концентрація стала рівною 0,2 моль/л? (0,75 л) 2. У розчині об’ємом 200 мл міститься натрій гідроксид масою 12 г. Визначте молярну концентрацію даного розчину. (1,5 моль/л) 3. Який об’єм розчину фосфатної кислоти з молярною концентрацією 6 моль/л треба взяти для приготування розчину кислоти об’ємом 0,5 л з молярною концентрацією еквівалентів 0,1 моль/л, вважаючи, що фосфатна кислота використовується для одержання натрій гідрогенфосфату? (4,17 мл) 4. У 45 г води розчинено 6,84 г цукру. Обчисліть молярні частки цукру і води. (0,008; 0,992) 5. Обчисліть молярну концентрацію еквівалентів розчину калій йодиду, 1 літр якого містить 0,0037 г калій йодиду. (0,02 моль/л) 6. Водний розчин містить 577 г сульфатної кислоти в 1 літрі. Густина розчину 1,335 г/мл. Обчисліть масову частку, молярну концентрацію, молярну концентрацію еквівалентів, моляльність і молярні частки сульфатної кислоти і води в отриманому розчині. (43,22 %; 11,76 моль/л; 5,88 моль/л; 7,76 моль/кг; 0,123; 0,877) 7. Обчисліть масову частку нітратної кислоти в розчині і моляльність розчину з молярною концентрацією еквівалентів кислоти 8 моль/л і густиною 1,246 г/мл. Які молярні частки кислоти і води в цьому розчині? (40,5 %; 10,8 моль/кг; 0,162 і 0,838) 8. Який об’єм розчину сульфатної кислоти з масовою часткою кислоти 96 % і густиною 1,835 г/мл потрібно взяти для приготування 5 л розчину з молярною концентрацією еквівалентів кислоти 0,5 моль/л? (0,14 л) 9. Змішані 0,8 л розчину з молярною концентрацією еквівалентів натрій гідроксиду 1,5 моль/л і 0,4 л з молярною концентрацією еквівалентів 0,6 моль/л. Яка молярна концентрація еквівалентів отриманого розчину? (1,2 моль/л) 10. Який об’єм розчину фосфатної кислоти з масовою часткою Н3РО4 36 % і густиною 1,216 г/мл потрібно для приготування 13 літрів розчину з молярною концентрацією еквівалентів фосфатної кислоти 0,15 моль/л? (0,142 л) 11. Визначте молярну концентрацію еквівалентів розчину фосфатної кислоти, якщо для нейтралізації 31 мл розчину лугу з молярною концентрацію еквівалентів 0,16 моль/л пішло 217 мл цього розчину. (0,023 моль/л) 12. Визначте об’єм розчину кислоти з молярною концентрацію еквівалентів 0,3 моль/л, який потрібний для нейтралізації розчину, що містить 0,32 г натрій гідроксиду в 40 мл. (26,6 мл) 13. Який об’єм розчину НСl з масовою часткою хлоридної кислоти 10 % і густиною 1,049 г/мл треба взяти для приготування розчину об’ємом 350 мл з молярною концентрацією еквівалентів 0,2 моль/л? (24,36 мл) 14. До якого об’єму потрібно розбавити розчин з масовою часткою плюмбум (ІІ) нітрату 30 %, об’ємом 25 мл і густиною 1,33 г/мл, щоб одержати розчин з молярною концентрацією солі 0,2 моль/л і густиною 1,08 г/мл? (150 мл) Таблиця 7. Відносна густина (ρ) та масова частка (w) розчинів хлоридної кислоти НСl (15оС)
Таблиця 8. Відносна густина (ρ) та масова частка (w) розчинів сульфатної кислоти H2SО4 (15оС)
Лабораторна робота № 4 ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 166; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.254.103 (0.008 с.) |

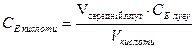 , моль/л ________________________________________________________________________________________________________________________________
, моль/л ________________________________________________________________________________________________________________________________