
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Енергетика хімічних процесівСодержание книги
Поиск на нашем сайте
Теоретична частина. Хімічні реакції найчастіше супроводжуються тепловими явищами, що вивчаються в особливому розділі хімії – термохімії. У цьому розділі використовують термохімічні рівняння, у яких зазначено тепловий ефект реакції. Тепловий ефект реакції – це кількість теплоти, що виділяється або поглинається в реакції при сталому тиску або об’ємі, причому продукти реакції мають таку ж температуру, що й вихідні речовини. Термохімічні розрахунки виконують за законом Гесса: тепловий ефект хімічної реакції при постійному тиску й об’ємі не залежить від способу її проведення, а залежить лише від початкового та кінцевого стану реагуючих речовин. Тепловий ефект реакції залежить від природи реагуючих речовин та їх агрегатних станів, тому в термохімічних рівняннях символами (г, р, т) позначають стан речовин – газоподібний, рідкий, твердий. Згідно з наслідком із закону Гесса: DH Стандартною ентальпією утворення називається кількість теплоти, яка виділяється або поглинається під час утворення 1 моль речовини з простих речовин. Стандартний стан у термохімії: температура 298 К, тиск 101,325 кПа. Стандартну ентальпію утворення Ентропія S – це функція стану, що характеризує прагнення системи до розупорядкування та зниження стійкості. Ентропію реакції можна визначити як різницю між сумою ентропій продуктів реакції та сумою ентропій вихідних речовин DS Енергія Гіббса DG є критерієм напрямку перебігу процесу. Якщо DG < 0 – процес самодовільний, якщо DG = 0, то система перебуває у стані рівноваги, якщо DG > 0 – процес несамодовільний. Енергія Гіббса також підпорядковується наслідку закону Гесса: DGx = ∑nпрод. Дослід 1. Визначення теплового ефекту хімічної реакції Обладнання та реактиви: калориметр, циліндр, термометр, розчин з молярною концентрацією натрій гідроксиду 1 моль/л, розчин з молярною концентрацією хлоридної кислоти 1 моль/л. Хід роботи 1. Зважте внутрішню склянку калориметра на технохімічних вагах. 2. Відміряйте циліндром 50 мл розчину натрій гідроксиду (NaOH), внесіть його в склянку і визначте температуру. 3. Відміряйте циліндром 50 мл розчину хлоридної кислоти (HCl). 4. Обполоскавши термометр дистильованою водою, опустіть його в розчин HCl і визначте температуру. 5. Розчин кислоти влийте у розчин лугу і простежте за зміною температури. Запишіть максимальну температуру розчину. 6. Отримані дані занесіть у таблицю 1. Таблиця 1
7. Виконайте розрахунки: 7.1. Теплота, що виділяється чи поглинається в калориметрі, розраховується за формулою: Q = (mp · Cp + mск · Сск) · Dt, де mp – маса розчину (г), Cp – питома теплоємність розчину дорівнює питомій теплоємності води, тобто 4,184 Дж/(г·К), mск – маса склянки (г), Сск – питома теплоємність скла дорівнює 0,753 Дж/(г·К). _____________________________________________________________________________________ _____________________________________________________________________________________7.2. Обчисліть кількість еквівалентів речовини (кислоти чи лугу), що приймає участь в реакції __________________________________________________________________________________________________________________________________________________________________________7.3. Обчисліть теплоту нейтралізації для 1 моль еквівалентів кислоти (чи лугу). ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ DН = – Q 7.4. Обчисліть тепловий ефект реакції нейтралізації одного еквівалента сильної кислоти (чи лугу). Обчисліть теоретичне значення теплового ефекту реакції Н+(р) + ОН–(р) = Н2О(р) за стандартними величинами ентальпії утворення речовин (DН __________________________________________________________________________________________________________________________________________________________________________ 8. Визначте відносну похибку досліду за формулою:
Висновок: ________________________________________________________________________________________________________________________________________________________________ _____________________________________________________________________________________ Контрольні питання та вправи 1. Що вивчає термохімія? 2. Дайте визначення тепловому ефекту реакції. Назвіть типи хімічних реакцій за тепловими ефектами? 3. Сформулюйте закон Гесса та його наслідки. 4. Як називаються рівняння, у яких зазначено тепловий ефект реакції? 5. Як визначити тепловий ефект реакції за стандартними ентальпіями утворення? 6. Від чого залежить тепловий ефект реакції? 7. Які параметри стандартного стану? 8. Що характеризує ентропія? 9. За значенням якої термодинамічної функції можна визначити напрямок перебігу процесу? 10.Визначте стандартну ентальпію утворення фосфіну РН3, користуючись рівнянням: 2РН3(г.) + 4О2(г.) = Р2О5(кр.) + 3Н2О(р.) DН0 = –2360 кДж 11. Обчисліть значення б) С6Н12О6 (к.) + 6О2 (г.) = 6СО2 (г.) + 6Н2О (р.) Яка з цих реакцій поставляє організму більше енергії? 12. Визначте 1) С2H4(г.) + 3О2 (г.) = 2СО2 (г.) + 2Н2О (г.); 2) С (графіт) + О2 (г.) = СО2 (г.); 3) Н2(г.) + ½O2(г.) = Н2O(г.) 13. Обчисліть значення б) 4HCl(г.) + O2(г.) = 2Cl2(г.) + 2H2O(р.); г) Fe2O3(кр.) + 3CO(г.) = 2Fe(кр.) + 3CO2(г.) 14. Обчисліть значення Таблиця 2
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.44.46 (0.006 с.) |

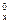 = ∑nпрод. H
= ∑nпрод. H 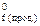 – ∑nвих. H
– ∑nвих. H  , тобто стандартна ентальпія реакції дорівнює різниці між сумою стандартних ентальпій утворення продуктів реакції (H
, тобто стандартна ентальпія реакції дорівнює різниці між сумою стандартних ентальпій утворення продуктів реакції (H 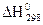 прости х речовин, які перебувають у стабільній модифікації, приймають за нуль.
прости х речовин, які перебувають у стабільній модифікації, приймають за нуль. – ∑nвих.
– ∑nвих. 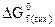 .
.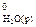 = –286,0 кДж/моль; DН
= –286,0 кДж/моль; DН 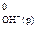 = – 230,2 кДж/моль; DН
= – 230,2 кДж/моль; DН 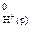 = 0).
= 0).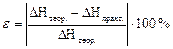
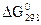 реакцій та визначте, які з них можливі в стандартних умовах при 25 оС: а) Cu(кр.) + ZnO(кр.) = CuO(кр.) + Zn(кр.); в) N2(г.) + 1/2O2(г.) = N2O(г.);
реакцій та визначте, які з них можливі в стандартних умовах при 25 оС: а) Cu(кр.) + ZnO(кр.) = CuO(кр.) + Zn(кр.); в) N2(г.) + 1/2O2(г.) = N2O(г.);


