
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ТЕМА: Величини, що характеризують кількісний склад розчинів.Содержание книги
Поиск на нашем сайте
2. ОБҐРУНТУВАННЯ ТЕМИ. Знання про розчини необхідні для лікаря. З утворенням розчинів безпосередньо пов’язані процеси засвоєння їжі та виведення з організму продуктів життєдіяльності. Розчинами є плазма крові, слина, шлунковий сік та інші рідини людського організму. У формі розчинів в організм вводиться багато лікарських препаратів (біохімія, фармакологія). Вивчення хімії неможліве без засвоєння таких початкових понять, як величини, що характеризують кількісний склад розчинів, сумішей та систем.
3. МЕТА: Сформувати уявлення про класифікацію розчинів та величини, що характеризують кількісний склад розчинів. Студент повинен знати: - величини, що характеризують кількісний склад розчинів; - формули для визначення масової частки, молярної концентрації, молярної концентрації еквівалента, титру та моляльної концентрації; - формули для визначення кількості речовини, кількості речовини еквівалента, молярної маси еквівалента, фактора еквівалентності; - види мірного посуду; вміти: - проводити розрахунки по визначенню маси (об’єму) розчиненої речовини, необхідної для приготування розчинів певної концентрації; - переводити одну форму вираження концентрації в іншу; оволодіти навичками: - зважування на технічних та аналітичних терезах. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДНІ ДЛЯ ЗАСВОЄННЯ ТЕМИ. 1) Поняття про розчини. 2) Концентрація розчинів: масова частка, молярна концентрація. 3) Проведення розрахунків по визначенню кількості розчиненої речовини для приготування розчинів з масовою часткою та молярною концентрацією. (Матеріал шкільної програми з хімії). ГРАФ ЛОГІЧНОЇ СТРУКТУРИ Р о з ч и н и
Класифікація Склад розчинів
Розчини у Величини, що характеризують життєдіяльності кількісний склад розчинів
Розрахунки по визначенню кількості розчиненої речовини для приготування розчинів певної концентрації
Зважування наважки на терезах
ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ (самостійна позааудиторна робота студентів)
ЗАДАЧІ ДЛЯ САМОСТІЙНОГО РОЗВ’ЯЗУВАННЯ
(самостійна позааудиторна робота студентів) Задача № 1. Вміст катіонів натрію в плазмі крові складає 142 ммоль/л. Визначити титр плазми по катіону натрію.
Задача № 2. Водний розчин, одержаний розчиненням 0,005 кг глюкози (Мr = 180) у 0,095 кг води, є ізотонічним по відношенню до плазми крові. Визначити масову та молярну частки глюкози в розчині.
Задача № 3. Титр розчину хлориду кальцію (Мr = 111), що використовується в медичній практиці при алергічних, шкіряних та інших захворюваннях дорівнює 0,0999 г/мл. Розрахувати молярну концентрацію та молярну концентрацію еквівалента хлориду кальцію в розчині та співвідношення між ними. Задача № 4. Визначити моляльність фізіологічного розчину, масова частка хлориду натрію в якому дорівнює 0,85%. Задача № 5. У лабораторії є розчин з масовою часткою хлориду натрію 10% та 0,5%. Визначити масу кожного з розчинів, що необхідна для приготування 0,5 л фізіологічного розчину з масовою часткою 0,85% та густиною 1,003 кг/л. ПРАВИЛЬНІ ВІДПОВІДІ Задача № 1. Титр (Т) означає масу розчиненої речовини, що міститься в 1 мл розчину. Масу частіше виражають у грамах (г).
Отже, маємо:
m(Na+) - маса катіонів натрію, г; V (розчину) - об'єм розчину, мл; n(Na+) - кількість речовини катіонів натрію, моль; М (Na+) - молярна маса катіону натрію, г/моль; Т (Na+) Задача № 2. Масова частка (W) - це відношення маси компоненту (розчиненої речовини) до загальної маси системи (розчину, суміші). Це безрозмірна величина, що виражається частками одиниці, відсотками (частки сотні), проміле (частки тисячі), млн-1 (частки мільйону).
Молярна частка ( χ)- це відношення кількості речовини компонента (розчиненої речовини) до загальної кількості речовини системи (розчину, суміші). Вона має таку ж розмірність, як і масова частка.
Задача № 3. Молярна концентрація речовини X, що позначається С(Х), - це відношення кількості речовини Х до об’єму розчину V. Молярна концентрація виражається в моль/м3, моль/л, або вїхпохідних (ммоль/л).
n – кількість речовини СаСl2, моль; V(розчину) – об’єм розчину, л. Якщо Т(СаСl2) = 0,0999 г/мл = 0,0999 кг/л, то в 1 л розчину маємо 0,0999 кг солі. Молярна концентрація еквівалента речовини X, що позначається як С(fX), - це відношення кількості речовини еквівалента n(fX)дo об’єму розчину. Молярна концентрація еквівалента виражається в моль/м3, моль/л, або в їх похідних (ммоль/л)
Еквівалент - це така частина речовини Х (реальна або умовна), що в реакції еквівалентна (відовідає)одному моль атомів водню (Гідрогену), або одному моль катіонів водню (Гідрогену), або в окисно-відновних реакціях - одному електрону. Фактор еквівалентності f показує, яка частка моль речовини відповідає її еквіваленту. Отже, для речовини Х фактор еквівалентності f(X) показує співвідношення між молярною масою еквівалента M(fХ) та молярною масою М(Х) речовини:
Наприклад для сірчаної кислоти Н2SO4: Отже, для СaCl2:
Задача № 4. Моляльна концентрація речовини X, що позначається Сm(X) є відношенням кількості речовини Х до маси розчинника У.
m(У) - маса розчинника, кг. Якщо масова частка хлориду натрію в розчині дорівнює 0,85%,тоце означає, що 0,85 г солі припадаєна 99,15 г води. Отже,
Задача № 5. По-перше, зробимо необхідні позначення: W1(NaCl) = 10% W2(NaCl) = 0,5% Wx(NaCl) = 0,85% Vx(розчину) = 0,5л ρx(розчину) = 1,003 кг/л
Знайдемо масу розчину, який треба приготувати: mx(розчину) = Vx(розчину) ×ρx(розчину) = 0,5×1,003 = 0,5015 кг 2) Проведемо розрахунки за правилом змішування ("хреста"). У загальному вигляді:
Або:
Знаходимо необхідні маси розчинів:
ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ. 8.1. Розв'язування задач на концентрацію розчинів. Задача № 1. У воді об’ємом 0,200 л розчинили сіль масою 0,040 кг. Визначити масову частку солі в розчині, якщо густина води дорівнює 1кг/л. Задача № 2. Визначити масу розчину з масовою часткою СuSО4 10% і масу води, що необхідні для приготування розчину масою 0,5 кг з масовою часткою СuSО4 2%. Задача № 3. Визначити молярну концентрацію розчину з масовою часткою гідроксиду Натрію 0,2. Густина розчину - 1,29 кг/л. Задача № 4. Визначити молярну концентрацію еквівалента розчину, утвореного при розчиненні 0,0426 кг сульфату Натрію в 0,3 кг води, якщо густина розчину дорівнює 1,12 кг/л, Задача № 5. Визначити моляльну концентрацію розчину хлориду Калію, якщо 0,5 кг розчину містить 0,05 кг солі. 8.4. Проведення зважуванняна технохімічних та аналітичних терезах. Терези повинні бути відрегульовані і підготовлені до роботи лаборантом. Речовини зважують охолодженими до кімнатної температури. Для зважування рекомендується використовувати спеціальний посуд: бюкси, стаканчики та спеціальний папір. Речовину, яку зважують, кладуть на ліву шальку терезів, а на праву - важки (починаючи з найбільших). Тримати важки у руках та ставати їх на стіл не дозволяється, їх треба брати тільки пінцетом. Коли треба зважити точну масу речовини (взяти точну наважку), на праву шальку встановлюють важки необхідної маси, а на ліву шальку поступово додають речовину до встановлення рівноваги. Знімати та класти на шальки речовину або важки дозволяється тільки тоді, коли терези знаходяться в аретованому стані (ручка аретира знаходиться в крайньому лівому положенні, коромисло опущене).
Для опрацювання техніки зважування взяти наважки таких речовин: 1,60 г NaCI; 0,52 г CaCI2; 2,50 г NaHСО3; 0,15 г ZnSO4; 0,07 г Н3ВО3.
ЛІТЕРАТУРА. 1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 95-100. 2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008. 3. Мороз А.С., Ковальова А.Г. Фіз. та колоїдна хімія. Львів. Світ, 1994, с.32-35, 3-4. 4. Садовничая Л.П. и др. Биофизичесая химия. Киев, Вища школа, 1986 с. 37-69.
ЗАНЯТТЯ № 6 1. ТЕМА: Приготування розчинів.
2. ОБҐРУНТУВАННЯ ТЕМИ. Розчини з молекулярним та іонним характером дисперсності розчиненої речовини - справжні розчини - найважливіша складова частина біологічних рідин. Водні розчини електролітів та низькомолекулярних речовин забезпечують постійний осмотичний тиск, активну реакцію середовища, буферні властивості рідин організму, регулюють величини мембранних потенціалів, активність ферментів тощо. Так знання теорії розчинів, а також методики їх приготування, необхідні для ycпішнoro засвоєння студентами біохімії, фармакології, фізіології, гігієни та ін. 3.МЕТА. Сформувати уявлення про роль розчинів у життєдіяльності організму і вивчити основні положення теорії розчинів; оволодіти методикою приготування розчинів точної концентрації. Студент повинен знати: - основні положення теорії розчинів; - формули для визначення кількості та маси розчиненої речовини, переводу масових одиниць в об’ємні; - системні і позасистемні одиниці вимірювання концентрації розчинів; вміти: - проводити розрахунки наважки розчиненої речовини для приготування розчину певної концентрації; - користуватися мірним посудом при приготуванні розчинів. оволодіти навичками: - приготування розчинів з концентраціями, що застосовуються в медичній практиці, а також для клінічних та хімічних досліджень (масова частка, молярна концентрація та молярна концентрація еквівалента).
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 1309; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.184.0 (0.009 с.) |


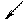
 розчинів
розчинів



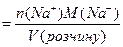 , де:
, де:
 г/мл
г/мл

 де:
де:




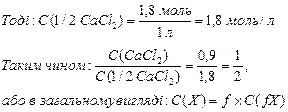
 : n(Х) - кількість речовини X, моль;
: n(Х) - кількість речовини X, моль;


 W1(NaCl)
W1(NaCl) 

 Wx(NaCl)
Wx(NaCl) W2(NaCl)
W2(NaCl) 


 10% 0,35 кг
10% 0,35 кг
 0,85%
0,85%
 0,5% 9,15 кг
0,5% 9,15 кг (розчину) =9,5 кг
(розчину) =9,5 кг Висновок: треба змішати 18,5 г розчину з W1=10%та 483 г розчину з W2= 0,5%.
Висновок: треба змішати 18,5 г розчину з W1=10%та 483 г розчину з W2= 0,5%.


