
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ТЕМА. Буферні системи, класифікація та механізм дії.Содержание книги
Поиск на нашем сайте
2. ОБҐРУНТУВАННЯ ТЕМИ. Одним з найважливіших аспектів гомеостазу організму людини є підтримування постійного значення рН, що здійснюється буферними системами та фізіологічними механізмами. Буферні системи регулюють концентрацію іонів водню та гідроксид-іонів, а також перебіг реакцій, що залежать від величини рН. Знання про буферні системи необхідні при вивченні біохімії, фізіології, фармакології та клінічних дисциплін. 3. МЕТА. Сформувати уявлення про буферні системи та механізм їх дії. Визначити вплив кислот, основ та розведення на рН буферних розчинів. Студент повинен знати: - визначення поняття "буферна система"; - класифікацію буферних систем за складом; - механізм буферної дії; - склад типових буферних систем; - фактори, що впливають на величину рН буферної системи; вміти: - складати рівняння реакцій, що характеризують буферну дію; - проводити розрахунки за рівнянням Гендерсона-Гассельбаха; оволодіти навичками: - визначення впливу кислот, основ та розведення на рН буферних розчинів. ОСНОВНІ БАЗОВІ ЗНАННЯ, ВМІННЯ І НАВИЧКИ, НЕОБХІДН ДЛЯ ЗАСВОЄННЯ ТЕМИ. 1) Поняття про сильні і слабкі електроліти. 2) Поняття про водневий показник і шкалу рН. 3) Методи визначення рН розчинів. (Матеріал шкільної програми та попередніх занять з хімії).
ГРАФ ЛОГІЧНОЇ СТРУКТУРИ.
Класифікація Механізм дії рН буферних
Склад типових Визначення впливу кислот, буферних систем основ, розведення на рН
6. ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ (самостійна позааудиторна робота студентів).
ЗАВДАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ (самостійна позааудиторна робота студентів) 1) Назвати кількість основних типів буферних систем (за складом); а) один; б) два; в) три; г) чотири 2) Вибрати правильну формулу для розрахунку рН буферної системи HCN - NaCN а) в)
3) Розрахувати рН буферного розчину, що був приготований з 0,040 л розчину аміаку з концентрацією 0,15 моль/л та 0,020 л розчину хлориду амонію з концентрацією 0,25 моль/л. а) 4,67; б) 6,42; в) 9,33; г) 10,12.
4) Пояснити, чому при додаванні невеликої кількості сильної кислоти до гідрогенкарбонатної буферної системи її рН практично не змінюється. а) підвищується ступінь дисоціації гідрогенкарбонату натрію; б) рівновага зміщується в бік утворення катіонів водню: CO2 + H2O == H+ + НСОз- в) під впливом сильних кислот розкладається вугільна кислота; г) сильна кислота замінюється еквівалентною кількістю слабкої вугільної кислоти. 5) Вказати, від яких факторів залежить рН буферної системи. а) від природи слабкого електроліту (кислоти чи основи); б) від співвідношення концентрацій компонентів буферної системи; в) від концентрації слабкого електроліту (кислоти чи основи); г) від концентрації солі.
ПРАВИЛЬНІ ВІДПОВІДІ 1) Правильна відповідь б). Буферні системи за складом бувають двох основних типів: - слабка кислота - сіль слабкої кислоти та лугу; - слабка основа - сіль слабкої основи та сильної кислоти.
2) Правильна відповідь а). Рівняння Гендерсона-Гассельбаха для цієї системи буде мати такий вигляд:
3) Правильна відповідь в). Приготований розчин належить до буферних розчинів основного типу. Для розрахунку значення його рН використовуємо рівняння;
рН буферного розчину дорівнює 9,33.
4) Правильна відповідьг). При додаванні сильної кислоти до гідрогенкарбонатного буферного розчину має місце її взаємодія з гідрокарбонатом натрію: Н+ + НСО3- = H2O + CO2 При цьому сильна кислота заміщується еквівалентною кількістю слабкої вугільної кислоти, іїї вплив на значення рН буде майже непомітним.
5) Правильні відповіді а) і б). рН буферної системи залежить від природи слабкого електроліту (рК) і співвідношення компонентів (
ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ. 8.1. Визначення впливу розведення на рН буферних розчинів. У першу пробірку налити 6 мл буферного розчину, в другу - 2 мл цього ж розчину та 4 мл дистильованої води. У кожну пробірку додати по 2 краплі індикатора метилового червоного. Зміст пробірок перемішати і порівняти забарвлення. 8.2. Визначення впливу кислоти та лугу на рН буферного розчину. У три пробірки налити по 4 мл буферного розчину з відомим значенням рН. Потім додати в одну пробірку 2 краплі розчину НСІ (С = 0,1 моль/л), у другу - 2 краплі розчину NaOH (С = 0,1 моль/л), у третю - 2 краплі дистильованої води і в кожну - по 2 краплі індикатора метилового червоного. Розчини перемішати і порівняти забарвлення. 8.3. Оформлення протоколу лабораторної роботи. За результатами спостережень зробити висновок про вплив кислот, лугів та розведення на рН буферних розчинів.
ЛІТЕРАТУРА. 1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 161-169. 2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008. 3. Садовничая Л.П., Хухрянский В.Г, Цыганенко А.Я. Биофизическая химия. Киев, Вища школа, 1986,с, 77-82. 4. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. Высшая школа. с. 90-96. ЗАНЯТТЯ № 11
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 652; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.141.201 (0.011 с.) |

 Буферні розчини
Буферні розчини

 буферних систем буферних систем систем
буферних систем буферних систем систем б)
б) 
 г)
г) 



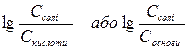 ).
).


