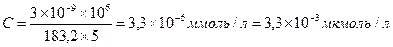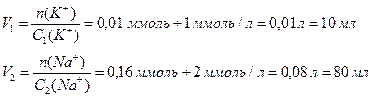Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основні базові знання, Вміння і Навички, необхідніСодержание книги
Поиск на нашем сайте
ДЛЯ ЗАСВОЄННЯ ТЕМИ. І) Основні величини, що характеризують склад розчинів. 2) Формули для обчислення концентрації розчину. 3) Зважування на технохімічних та аналітичних терезах. (Матеріал шкільної програми та попереднього заняття з хімії)
ГРАФ ЛОГІЧНОЇ СТРУКТУРИ
Сольватна Термодинаміка По разрахованій З фіксаналів
розчинів Розчинність розчинів масових розчинів об’ємних
газів рідин твердих речовин
ОРІЄНТОВНА КАРТКА ДЛЯ САМОПІДГОТОВКИ ДО ЗАНЯТТЯ (для самостійної позааудиторної роботи студентів)
ПИТАННЯ ДЛЯ САМОСТІЙНОГО ОПРАЦЮВАННЯ (самостійна позааудиторна робота студентів) 1) Чому при розчиненні нітрату амонію у воді розчин має нижчу температуру, ніж повітря, а при розчиненні сірчаної кислоти – набагато більшу? 2) Чим відрізняється склад водного розчину цукру від водного розчину хлориду натрію? 3) Чому водолаз з великих глибин повинен підніматися поступово, повільно, а не швидко? 4) Уведення в організм людини 3×10-9 кг адреналіну (Мr = 183,2) викликає збільшення частоти пульсу. Розрахувати діючу в цьому випадку концентрацію адреналіну в організмі, припустивши, що людина масою 70 кг має 5 л крові. 5) Для визначення калію в слині методом полуменевоі фотометрії потрібно приготувати 0,25 л розчину, що містить 0,04 ммоль/л катіону калію та 0,64 ммоль/л катіону натрію. Як приготувати такий розчин з розчину (І) хлориду калію (С1(К+) = 1ммоль/л) та розчину (2) хлориду натрію (С2(Nа+) = 2 ммоль/л)? 6) Який об’єм розчину з масовою часткою сірчаної кислоти 9,3% (густина 1,06 кг/л) необхідно взяти для приготування 0,05 л розчину з молярною концентрацією еквівалента сірчаної кислоти 0,35 моль/л? ПРАВИЛЬНІ ВІДПОВІДІ 1) Згідно з теорією розчинів, при розчиненні мають місце два процеси: руйнування, розклад первинної структури (кристалічної, аморфної, надмолекулярної) та побудова сольватів - утворень продуктів розпаду з молекулами розчинника (для води такі утворення називаються гідратами). Перший процес є ендотермічним, тобто проходить з поглинанням енергії, а другий - екзотермічний (проходить з виділенням енергії). Розчинення нітрату амонію супроводжується зниженням температури. Це означає, що руйнування кристалічної структури потребує більше енергії, ніж виділяється при утворенні гідратів. А при розчиненні сірчаної кислоти, навпаки, виділяється набагато більше енергії при утворенні гідратів, ніж у першому процесі.
2) Згідно з теорією, обидва розчини складаються з молекул і асоціатів води та гідратів молекул цукру (розчин цукру) і гідратів катіонів натрію, хлорид-іонів (розчин хлориду натрію). Розчин цукру не містить гідратованих іонів, а в розчині солі немає гідратованих молекул.
3) Якщо водолаз працює на значній глибині, то розчинність азоту повітря, яким він дихає, у нього в крові зростає. Це пов'язано з тим. що із збільшен-ням глибини підвищується і тиск. А, як відомо, розчинність газів із підвищенням тиску зростає. Коли водолаза піднімати на поверхню без необхідної поступовості, то азот починає виділятися з такою швидкістю, що може викликати розрив судин або їх закупорювання. У літературі наведені випадки загибелі водолазів від кесонної хвороби.
4) Вміст адреналіну в крові людинивизначається в ммоль/л.
адреналіну, ммоль. m – маса адреналіну, кг; М – молярна маса адреналіну, кг/кмоль; 106 – перехідний коефіцієнт від кмоль до ммоль
На одиницю маси людини концентрація адреналіну складає: W (адреналіну) = 4,3×10-9% У позасистемних одиницях концентрація адреналіну має такі значення: 0,43×10 -10 кг/кг × 10-1×10-6 = 4,3×10-6 мг% або 4,3×10-3 мкг%.
5) Визначаємо кількість речовини катіонів калію та натрію у 0,25 л розчину: n(K+) = C(K+)×V = 0,04×0,25 = 0,01 ммоль n(Na+) = C(Na+)×V = 0,64×0,25 = 0,16 ммоль Визначаємо об’єми розчинів (1) та (2):
Для приготування 0,25 л потрібного розчину необхідно відібрати піпеткою 10 мл розчину (1) та 80 мл розчину (2), перенести ці об’єми у мірну колбу місткістю 0,25 л, довести рівень розчину дистильованою водою до риски. Готовий розчин перемішати.
6) Визначаємо кількість речовини еквівалента кислоти, що містить розчин, який треба приготувати: n(1/2H2SO4) = C(1/2H2SO4)×V = 0,35 × 0,05 = 0,0175 моль Визначаємо масу кислоти: m(H2SO4) = n(1/2H2SO4) × M(1/2H2SO4) = 0,0175× 49 = 0,8575 г Визначаємо масу розчину кислоти, який необхідно взяти для приготування заданого розчину:
Розраховуємо об’єм цього розчину:
Отже: для приготування 0,05 л розчину з молярною концентрацією еквівалента сірчаної кислоти 0,35 моль/л треба взяти 8,7 мл (піпеткою) розчину сірчаної кислоти з масовою часткою 9,3%, перенести в мірну колбу місткістю 50 мл та довести об’єм розчину у колбі дистильованою водою до риски. ВКАЗІВКИ ДО РОБОТИ СТУДЕНТІВ НА ЗАНЯТТІ. 8.1. Приготування розчинівіз фіксаналів. Для приготування розчину із фіксаналу необхідно вміст ампули кількісно перенести у мірну колбу та розвести дистильованою водою до мітки. Перенесення вмісту фіксаналу в колбу: етикетку або напис з ампули зняти, ампулу вимити і промити дистильованою водою. У мірну колбу потрібного об’єму (1,0; 0,5; 0,25 л) вставляють лійку діаметром 9-10 см, в якій розміщують бойок з розширенням. Цим бойком пробивають фіксанал з одного боку, тримаючи фіксанал вертикально. Іншим бойком пробивають фіксанал з другого боку і дають змогу вмісту його перейти крізь лійку у колбу. Не змінюючи положення ампули, її обережно, але ретельно промивають дистильованою водою. Об’єм води повинен не менше, ніж у шість разів перевищувати об’єм фіксаналу. Після розчинення вмісту ампули об’єм рідини у колбі доводять дистильованою водою до мітки. Готовий розчин ретельно перемішують. 8.2. Приготування розчинів заданої концентрації по розрахованій наважці. Кожний студент одержує у викладача картку з індивідуальним завданням: приготувати розчин лікарського препарату певної концентрації з поясненням застосування його в медичній практиці. Спочатку виконує необхідні розрахунки, а потім, з дозволу викладача, готує розчин. Приготування розчину масової концентрації. Розраховану наважку речовини зважити на технохімічних терезах, перенести її в будь-який немірний посуд та додати розраховану кількість води. Готовий розчин перемішати до розчинення наважки. Приготування розчинів молярної концентрації та молярної концентрації еквівалента. Розраховану наважку зважити на аналітичних терезах (рідкі речовини відбирають піпеткою), кількісно перенести у мірну колбу потрібного об’єму (у колбу перед цим внести невеликий об’єм дистильованої води). Наважку спочатку розчинити у воді, а потім долити у колбу дистильовану воду до мітки. Готовий розчин перемішати. Кожен студент одержує у викладача картку з індивідуальним завданням приготувати розчин певної концентрації. 8.3. Оформлення протоколу лабораторної роботи. Зробити у зошиті необхідні розрахунки та описати порядок приготування розчину згідно з індивідуальним завданням.
ЛІТЕРАТУРА. 1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. –В: НОВА КНИГА, 2006, с. 87-94, 100-111.. 2. Медицинская химия: учеб. / В.А. Калибабчук, Л.И. Грищенко, В.И. Галинская и др.; под ред. В.А. Калибабчук. – К.: Медицина, 2008. 3. Мороз А.С. Ковальова А.Г. Фізична та колоїдна хімія. Львів, Світ. 1994, с. 30-35. 4. Садовничая Л.П.. Хухрянский В.Г. Биофизическая химия. Киев, Вища школа. 1986, с.37-68 5. Ленский А.С. Ввдение в бионеорганическую химию. М., Высшая школа, 1989, с. 93-112.
ЗАНЯТТЯ № 7
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 439; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.2.6 (0.008 с.) |



 Теорія розчинів Приготування розчинів
Теорія розчинів Приготування розчинів



 теорія розчинів наважці
теорія розчинів наважці

 концентрацій концентрацій
концентрацій концентрацій n – кількість речовини
n – кількість речовини