
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рівновага в процесах абсорбціїСодержание книги
Поиск на нашем сайте
Таким чином, рівновага в системі газ (пара) — рідина може характеризуватися трьома параметрами, наприклад температурою, тиском і складом однієї з фаз. Рівновага в системі газ — рідина визначається законом розчинності Генрі, згідно якому при даній температурі молярна частка газу в розчині (розчинність) пропорційна парціальному тиску газу над розчином:
х=р/Е, (7.1)
де р — парціальний тиск газу над розчином; х — молярна концентрація газу в розчині; Е — коефіцієнт пропорційності (коефіцієнт Генрі). Закон Генрі розповсюджується в першу чергу на слаборозчинні гази, а також на розчини з низькими концентраціями добре розчинних газів за відсутності хімічної реакції. Коефіцієнт Е має розмірність тиску, співпадаючу з розмірністю р, і залежить від природи речовини, що розчиняється, і температури. Встановлено, що із збільшенням температури розчинність газу в рідині зменшується. Коли в рівновазі з рідиною знаходиться суміш газів, закону Генрі може слідувати кожний з компонентів суміші окремо. Оскільки тепловий ефект, супроводжуючий процес абсорбції, негативно позначається на положенні лінії рівноваги, він повинен обов'язково враховуватися при розрахунках. Кількість теплоти, що виділяється при абсорбції, може бути визначене по залежності
де qд– диференціальна теплота розчинення в межах зміни концентрації х1-х2; L – кількість абсорбенту. Якщо абсорбція ведеться без відведення теплоти, то можна допустити, що вся теплота, що виділяється, йде на нагрівання рідини, і температура останньої підвищується на величину
де с - теплоємність розчину. Для пониження температури початкову газову суміш і абсорбент охолоджують, відводячи теплоту, що виділяється в процесі абсорбції, за допомогою вбудованих (внутрішніх) або зовнішніх теплообмінників. Парціальний тиск газу, що розчиняється, в газовій фазі, відповідний рівновазі, може бути визначений за законом Дальтона, згідно якому парціальний тиск компоненту в газовій суміші рівний загальному тиску, помноженому на молярну частку цього компоненту в суміші, тобто
р = Ру або у = р/Р, (7.2)
де Р — загальний тиск газової суміші; у — молярна концентрація газу, що розподіляється в суміші. Зіставляючи рівняння (7.2) і (7.1), знайдемо
де Аравн = Е/Р — константа фазової рівноваги, застосовна для областей дії законів Генрі і Дальтона. Хай Раб — тиск пари чистого абсорбенту в умовах абсорбції; раб — парціальний тиск пари абсорбенту в розчині; Р — загальний тиск; х — молярна частка газу, що абсорбується, в розчині; у — молярна частка розподілюваного газу в газовій фазі; уаб — молярна частка абсорбенту в газовій фазі. Згідно закону Рауля парціальний тиск компоненту в розчині рівний тиску пари чистого компоненту, помноженому на його молярну частку в розчині:
За законом Дальтона (10.2) парціальний тиск абсорбенту в газовій фазі рівний
При рівновазі
Аналіз чинників, що впливають на рівновагу в системах газ (пара) — рідина, дозволив встановити, що до параметрів, поліпшуючих умови абсорбції, відносяться підвищений тиск і знижена температура, а до чинників, сприяючих десорбції, — знижений тиск, підвищена температура і введення в абсорбент добавок, що зменшують розчинність газів в рідинах. 7.3 Матеріальний баланс процесу абсорбції
Матеріальний баланс виражається диференціальним рівнянням
або інтегральним рівнянням
де G — потік газової суміші (інертного газу), кмоль/с; L — потік абсорбенту, кмоль/с; Yн і Yк — початковий і кінцевий вміст розподілюваної речовини в газовій фазі, кмоль/кмоль інертного газу; Хк і Хн— початковий і кінцевий вміст розподілюваної речовини в абсорбенті, кмоль/кмоль абсорбенту; М— кількість розподілюваної речовини, перенесеної з фази G у фазу L в одиницю часу, кмоль/с. З рівняння матеріального балансу (7.5) можна визначити необхідну загальну витрату абсорбенту
або його питому витрату
Процес абсорбції характеризується також ступенем витягання (поглинання), представляючого відношення кількості фактично поглиненого компоненту до кількості, поглинальної при повному його витяганні,
7.4 Кінетика процесу абсорбції
Кінетика процесу характеризується трьома основними стадіями, які відповідають схемі, представленій на рис. 3.1. Перша стадія — перенесення молекул компоненту, що абсорбується, з ядра потоку газу (пара) до поверхні розділу фаз (поверхні рідини). Друга стадія — дифундування молекул компоненту, що абсорбується, через поверхневий шар рідини (межа розділу фаз). Третя стадія — перехід молекул речовини, що абсорбується, від поверхні розділу фаз в основну масу рідини. Кінетичні закономірності абсорбції відповідають загальному рівнянню масопередачі для двофазних систем:
Експериментально встановлено, що друга стадія процесу абсорбції йде з більшою швидкістю і не впливає на загальну швидкість процесу, обмежену швидкістю найповільнішої стадії (першої або третьої). Рушійна сила процесу абсорбції для I і III стадій в рівняннях (7.5а) і (7.6а) може бути виражена через інші параметри:
У рівняннях (7.5б) і (7.6б) р — робочий парціальний тиск розподілюваного газу в газовій суміші; рравн — рівноважний тиск газу над абсорбентом, відповідний робочій концентрації в рідині; С — робоча об'ємна молярна концентрація розподілюваного газу в рідині; Сравн — рівноважна об'ємна молярна концентрація розподілюваного газу в рідині, відповідна робочому парціальному тиску його в газовій суміші. При такому виразі рушійної сили процесу абсорбції рівняння рівноважної залежності приймає вигляд
де Ψ — коефіцієнт пропорційності, кмоль/(м3∙ Па). Коефіцієнти масопередачі виражаються для рівнянь (7.5а) і (7.6а) у вигляді
для рівнянь (7.5б) і (7.6б)
У рівняннях (7.7) і (7.8)
Коефіцієнти масовіддачі по газу і рідині
для газової фази для рідкої фази Величина коефіцієнта Ψ робить істотний вплив на кінетику процесу абсорбції. Якщо Ψ має високі значення (висока розчинність компоненту — дифузійний опір зосереджений в газовій фазі), то
Так само, як для масообмінних процесів при Середня рушійна сила в рівняннях (7.5а) і (7.6а) визначається у разі прямолінійної рівноважної залежності через відносні молярні концентрації компонентів по залежностях (2.1) і (2.2). Ці ж залежності можна використовувати і при виразі рушійної сили процесу абсорбції через парціальний тиск розподілюваного компоненту в газі або об'ємні молярні концентрації цього ж компоненту в рідині в рівняннях (7.5б) і (7.6б)
Тут У випадку При проведенні процесу абсорбції, супроводжуваною хімічною реакцією (хемосорбція), що протікає в рідкій фазі, частина компонента, що розподіляється, переходить у хімічно зв'язаний стан. У результаті цього концентрація розчиненого (фізично зв'язаного) компонента, що розподіляється, у рідині зменшується, що приводить до збільшення рушійної сили процесу в порівнянні з чисто фізичною абсорбцією. Швидкість хемосорбції залежить як від швидкості масопередачі, так і від швидкості хімічної реакції. У цьому випадку розрізняють дифузійну і кінетичну області протікання хемосорбції. У дифузійній області швидкість процесу визначається швидкістю масопередачі, у кінетичній — швидкістю хімічної реакції. У тих випадках, коли швидкості масопередачі і реакції порівнянні, процеси хемосорбції протікають у змішаній, або дифузійно-кінетичній, області. При розрахунку хемосорбції коефіцієнт масовіддачі в рідкій фазі, що враховує хімічну реакцію, що протікає в ній
Фактор Фм визначають по графічних залежностях.
Лекція 8 ПРИНЦИПОВІ СХЕМИ АБСОРБЦІЇ
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 747; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

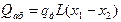 ,
,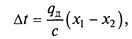
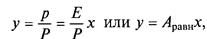 (7.3)
(7.3) (7.4)
(7.4) .
.
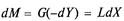
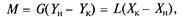 (7.5)
(7.5)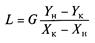
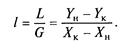

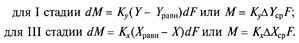 (7.5а) (7.6а)
(7.5а) (7.6а)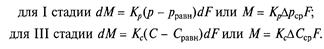 (7.5б) (7.6б)
(7.5б) (7.6б)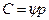 ,
,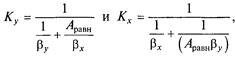 (7.7)
(7.7)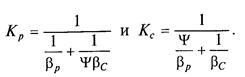 (7.8)
(7.8)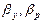 - коефіцієнти масовіддачі від потоку газу до поверхні контакту фаз;
- коефіцієнти масовіддачі від потоку газу до поверхні контакту фаз; 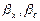 - коефіцієнти масовіддачі від поверхні контакту фаз до потоку рідини.
- коефіцієнти масовіддачі від поверхні контакту фаз до потоку рідини.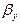 і
і  можуть бути визначені з критерійних рівнянь, що мають вигляд:
можуть бути визначені з критерійних рівнянь, що мають вигляд: ;
;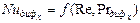 .
.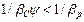 або
або 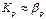 . Якщо Ψ мало (витягуваний компонент важко розчинимий — дифузійний опір зосереджений в рідкій фазі), то
. Якщо Ψ мало (витягуваний компонент важко розчинимий — дифузійний опір зосереджений в рідкій фазі), то 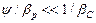 і можна вважати
і можна вважати  .
.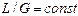 , робочі лінії процесу абсорбції є прямими і описуються у разі протитечії рівнянням (1.4), а прямотоку — рівнянням (1.5).
, робочі лінії процесу абсорбції є прямими і описуються у разі протитечії рівнянням (1.4), а прямотоку — рівнянням (1.5).
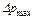 ,
, 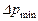 — більше і менше значення рушійної сили на початку і кінці процесу абсорбції, виражені через різницю парціальних тисків компонента, що поглинається
— більше і менше значення рушійної сили на початку і кінці процесу абсорбції, виражені через різницю парціальних тисків компонента, що поглинається  ;
; 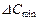 , - більше і менше значення рушійної сили на початку і кінці процесу абсорбції, виражені через об'ємні мольні концентрації компонента, що поглинається, у рідині.
, - більше і менше значення рушійної сили на початку і кінці процесу абсорбції, виражені через об'ємні мольні концентрації компонента, що поглинається, у рідині.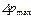 /
/ 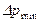
 ,
, 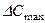 /
/ 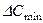
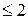 при збереженні лінійності рівноважної залежності середня рушійна сила процесу абсорбції може дорівнювати середньоарифметичному цих значень.
при збереженні лінійності рівноважної залежності середня рушійна сила процесу абсорбції може дорівнювати середньоарифметичному цих значень.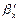 , може бути виражений через коефіцієнт масовіддачі при фізичній абсорбції
, може бути виражений через коефіцієнт масовіддачі при фізичній абсорбції 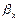 з урахуванням фактора прискорення масообміну Фм, що показує, у скільки разів збільшиться швидкість абсорбції за рахунок протікання хімічної реакції:
з урахуванням фактора прискорення масообміну Фм, що показує, у скільки разів збільшиться швидкість абсорбції за рахунок протікання хімічної реакції: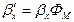 .
.


