
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловий баланс кристалізаціїСодержание книги
Поиск на нашем сайте
Тепловий баланспроцесу ізогідричної кристалізації може бути записаний у вигляді
де сн, cк, cL, сох — теплоємності початкового і маткового розчинів, кристалів і охолоджуючого агента; tн, tк, tL, tox. н, tox . к – температури початкового і маткового розчинів, кристалів, початкова і кінцева охолоджуючого агента; Wох — потік охолоджуючого агента; qкрист — теплота кристалізації; Qп — втрати теплоти. Рівняння (10.4) і (10.1) дозволяють визначити витрату охолоджуючого агента для здійснення процесу ізогідричної кристалізації
Тепловий баланс процесу кристалізації методом видалення розчинника при нагріванні розчину глухою парою може бути записаний у вигляді
((10.5)
де Dгр.п — витрата гріючої пари; iS, iконд, iW — ентальпії гріючої пари, конденсату і видаленого у вигляді пари розчинника відповідно. По рівнянню (10.6) визначають необхідну витрату гріючої пари
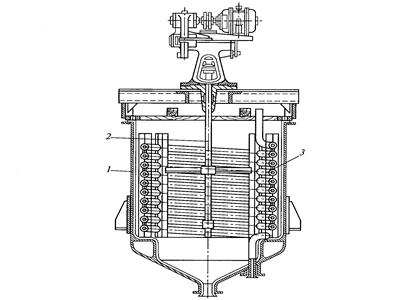
10.4 Устаткування кристалізації Технологічний процес кристалізації з розчинів складається з наступних стадій: кристалізація; відділення кристалів, що утворилися; перекристалізація; промивка і сушка кристалів. Останні дві стадії не є обов'язковими і призначаються відповідно до вимог до кінцевого продукту. Перша із стадій здійснюється в апаратах спеціальних конструкцій — кристалізаторах. Відмінність вимог до цільового продукту і умов здійснення процесу зумовило різноманіття конструкцій кристалізаторів. За способом роботи вони діляться на апарати періодичної і безперервної дії. Апарати періодичної дії використовують звичайно в установках кристалізацій невеликої продуктивності. Вони достатньо економічні, прості по конструкції і забезпечують необхідну якість продукту. Недоліком є відносно велика частка допоміжних операцій (завантаження, розвантаження і т.д.). Кристалізатори безперервної дії застосовують в умовах забезпечення високої продуктивності. За способом створення пересичення всі кристалізатори можна розділити на випарні, охолоджувальні, випарні, хімічні і ін. Випарні кристалізатори, використовувані для проведення ізотермічної кристалізації з видаленням частини розчинника у вигляді пари, частіше всього представляють випарні апарати (див. гл. 7) з внутрішньою циркуляційною трубою, підвісною гріючою камерою, виносною гріючою камерою і інші, як при природній, так і вимушеній циркуляції розчину. Проте при кристалізації виникають специфічні умови — наявність твердої фази в розчині, можливість відкладення кристалів на стінках апарату і гріючих трубках, необхідність регулювання розміру кристалів в продукті. Все це вимагає ряду змін в конструкції звичних випарних апаратів. На рис. 10.2 зображений випарний апарат — кристалізатор 1 з підвісною нагрівальною камерою 2 і двома працюючими по черзі нутч-фільтрами 3 для відділення кристалів. Випарний апарат — кристалізатор 1 з винесеною нагрівальною камерою 2 і збірником кристалів 3 показаний на рис. 10.3. Охолоджувальні кристалізатори застосовують для ізогідричної кристалізації розчинів речовин з прямою розчинністю. У малотоннажних виробництвах застосовують кристалізатори, обладнані перемішуючими пристроями, теплообмінними оболонками або змійовиками. На рис. 15.4 показаний кристалізатор 1 ємнісного типу із змійовиком 3, розташованим усередині апарату, і лопатевою мішалкою 2. Для безперервної кристалізації застосовують барабанний кристалізатор 1 (рис. 10.5), що є циліндровою ємністю з водяною оболонкою 2, встановленою на роликах 3 під невеликим кутом до горизонту. Недоліком цих апаратів є значна кристалізація внутрішньої поверхні апарату, тому для руйнування кристалів на стінці в барабан можуть поміщати спеціальні насадки (ланцюги і штанги).
Рис. 10.2 – Схема випарного каталізатора з підвісною гріючою камерою: 1 – кристалізатор; 2 – гріюча камера; 3 нутч-фільтр
Рис. 10.3 – Схема випарного кристалізатора з винесеною гріючою камерою: 1 – кристалізатор; 2 – гріюча камера; 3 – збірник кристалів
Випарні кристалізатори можна розділити на кристалізатори з повітряним охолодженням і вакуум-кристалізатори. У апаратах першої групи охолоджування розчину проводиться шляхом безпосереднього зіткнення його з повітрям. Внаслідок цього одночасно з охолоджуванням відбувається випаровування частини розчинника. У вакуум-кристалізаторах створюється знижений тиск за допомогою вакуум-насосу, що сприяє випаровуванню частини розчинника з одночасним охолоджуванням розчину. Апарати цього типу знайшли широке розповсюдження в промисловості завдяки високій продуктивності, герметичності, простоті виготовлення і обслуговування, надійності в роботі. Хімічні кристалізатори використовуються для проведення в одному апараті хімічної реакції і кристалізації твердої фази, що утворюється при цьому.
Контрольні питання
1. У чому полягають призначення і основні принципи процесу кристалізації? 2. Які технічні способи процесу кристалізації використовують в промисловості? 3. Які типи апаратів використовуються для здійснення процесу кристалізації?
Рис. 10.4 – Схема кристалізатора ємнісного типу з змієвиком і мішалкою: 1 – кристалізатор; 2 – лопатева мішалка; 3 – змійовик
Рис. 10.5 – Схема барабанного кристалізатора: 1 – барабанний кристалізатор; 2 – водяна оболонка; 3 -- ролик
Лекція 11 АДСОРБЦІЯ Процес адсорбції Адсорбція — масообмінний процес виборчого поглинання компонентів з газових (парових) систем і рідин твердими поглиначами-адсорбентами. Адсорбція широко застосовується в промисловості при очищенні і осушенні газів, виділенні компонентів з розчинів, розділенні газорідинних сумішей. Процес адсорбції використовується в хроматографічних методах розділення газових сумішей і в газовій хроматографії — ефективному методі аналізу складу газів і пари, а також як один з методів інженерного захисту навколишнього середовища. В порівнянні з іншими масообмінними процесами адсорбція найбільш ефективна у разі малого вмісту витягуваного компоненту в початковій суміші. Розрізняють два види адсорбції: фізичну і хімічну. Фізична адсорбція викликається силами взаємодії молекул поглинальної речовини з адсорбентом без утворення хімічних зв'язків. Хімічна адсорбція (хемосорбція) характеризується хімічною взаємодією між середовищем і адсорбентом, що дозволяє утворювати нові хімічні з'єднання на поверхні і усередині адсорбенту. Обидва види адсорбції екзотермічні. Проте якщо теплота, що виділяється при фізичній адсорбції газів і пари порівнянна з їх теплотою конденсації (85...125 кДж/кмоль), а у разі розчинів навіть менше, то теплота хімічної адсорбції досягає декількох сотень кДж/кмоль. Десорбція — процес зворотний адсорбції, полягаючий у витяганні з адсорбенту адсорбованих речовин, призначений для відновлення його первинних властивостей. До сорбційних процесів відносяться також іонообмінні процеси, щополягають у взаємодії розчинів електролітів з сорбентами-іонітами, що володіють здатністю обмінювати присутні в них вільні іони на іони, що знаходяться в розчині. Простота і висока ефективність іонообмінних процесів дозволяє реалізувати їх на будь-якому рівні: від лабораторних колонок і тонких шарів, до багатотонних промислових фільтрів. Ці процеси застосовуються для глибокого очищення розчинів (демінералізація води в теплоенергетиці, видалення із стічних вод шкідливих домішок, регенерація електролітів гальванічних цехів); отримання кислот і лугів з солей, а також солей необхідного складу; витягання металів із збіднених руд і океанічних вод і т.д.
11.2 Рівновага в процесах адсорбції Рівновага сорбційних процесів описується у вигляді залежностей поглинальної здатності від температури і концентрації витягуваної речовини. Оскільки умови адсорбційної рівноваги вивчають при постійній температурі, одержувана функція називається ізотермою адсорбції. Конкретна форма цієї залежності визначається властивостями і механізмом взаємодії адсорбенту і речовини, що адсорбується. В даний час у зв'язку з різноманітністю адсорбентів і речовин, що адсорбуються, єдина теорія адсорбції не розроблена, але на підставі різних моделей запропоновані різні види ізотерм. До них відносяться рівняння Ейкена і Поляні, Брунауера, Еммета, Теллера і ін. Великий внесок у розвиток теорії і практики процесів адсорбції в нашій країні належить академіку М. М.Дубініну. Для опису фізичної адсорбції найбільше застосування одержала теорія Ленгмюра, ізотерма адсорбції якої описується рівнянням
(11.1)
де Х — рівноважна концентрація поглиненої адсорбентом речовини, кг/кг адсорбенту; р — рівноважний тиск поглинальної речовини в парогазовій суміші; а, b — константи, визначувані дослідним шляхом. У ряді випадків замість рівняння (11.1) використовується ізотерма Фрейндліха, що має вигляд
де Y— рівноважна концентрація поглинальної речовини в парогазовій суміші або розчині, кг/кг інертної частини; к, п, А, В — константи, визначувані дослідним шляхом. Кількість речовини, поглиненої адсорбентом, часто називають активністю а. На активність впливають наступні чинники. 1. Природа поглинальної речовини. Як правило, активність тим вище, чим більше молекулярна вага поглинального газу, а у разі розчинів — чим менше розчинність поглинальної речовини в рідині. 2. Температура. Із збільшенням температури рівноважна активність адсорбенту зменшується. 3. Тиск. Із збільшенням тиску рівноважна активність адсорбенту збільшується. 4. Домішки у фазі, з якої поглинається речовина, зменшують рівноважну активність. Розглянуті чинники роблять протилежний вплив на процес десорбції, якому сприяють підвищення температури адсорбенту, пониження тиску, наявність у фазі над адсорбентом домішок (витісняючої) речовини. У промислових умовах десорбцію часто проводять насиченою водяною парою, оскільки при цьому виконуються практично всі вищеперелічені умови. Важливими характеристиками адсорбенту є його статична і динамічна активності. Статична активність — кількість речовини, що адсорбується, яка поглинається до моменту досягнення рівноваги одиницею маси (об'єму) адсорбенту при даній температурі. Динамічна активність — кількість речовини, що адсорбується, поглиненої одиницею маси (об'єму) адсорбенту при пропусканні через нього газу або рідини до початку проскакування. Момент проскакування — це момент виявлення поглинальної речовини в потоці газу або рідини, що виходить з адсорбера. Динамічна активність завжди менше за статичну. Тому витрату адсорбенту на установку визначають звичайно по динамічній активності адсорбенту. Якщо є шар адсорбенту заввишки Н > Н0, тривалість його поглинювальної дії τ визначається рівнянням Н.А.Шилова, одержаним їм для визначення часу захисної дії протигаза,
де к — коефіцієнт поглинювальної дії, с/м; H0 — висота шару адсорбенту, на якому за час τ0 формується профіль фронту рівних концентрацій, м. Значення к, Н0 і τ0 визначаються експериментально. Стан рівноваги при іонному обміні, так само як і при адсорбції, описується ізотермами рівноваги, до яких із задовільною збіжністю відносяться рівняння Ленгмюра (11.1) і Фрейндліха (11.2). На рівновагу в процесі іонного обміну впливають природа іоніту і поглинальних іонів, температура і рН розчину. Так, у разі іонної сорбції двох іонів з різними зарядами іоніт переважно поглинає іон з найбільшим зарядом. Активність і вибірковість іонітів також зменшується при підвищенні температури. Вплив рН розчину на стан рівноваги різний: із збільшенням рН місткість катіонітів збільшується, а для аніонітів — зменшується.
11.3 Адсорбенти і іонообмінні смоли Як адсорбенти в промисловості використовують тверді матеріали, що володіють великою питомою поверхнею. Істотне значення має також хімічна стійкість адсорбенту в робочому середовищі, його механічна міцність і крупність частинок. Активоване вугілля — одна з найпоширеніших груп адсорбентів, одержуваних шляхом сухої перегонки природних вуглецевих матеріалів (дерево, кістка і ін.). Активоване вугілля має питому поверхню 600... 1700 м2/г і володіють гідрофобними властивостями (поглинають органічні речовини і не поглинають воду). Цей адсорбент застосовується для виділення речовин як з газової, так і з рідкої фаз. Недоліки активованого вугілля — горючість і низька механічна міцність. Силікагель — висушений гель двоокису кремнію. Різні сорти силікагеля мають питому поверхню 300... 800 м2/г. Розмір пор може змінюватися в широких межах залежно від прийнятої технології приготування. Силікагель найміцнішим в порівнянні з іншими адсорбентами. Будучи гідрофільним адсорбентом, він не може використовуватися для поглинання компонентів з водних розчинів, але успішно застосовується при адсорбції з газів і з неводних розчинів. Алюмогель, одержуваний термічною обробкою гідрата оксиду алюмінію, гідрофільний, так само як і силікагель, він може застосовуватися при температурах вище 500 ° С. Особлива увага надається в даний час використовуванню молекулярних сит, тобто адсорбентів з дуже тонкими порами, розміри яких порівнянні з розмірами молекул. Як молекулярні сита використовуються цеоліти — водні алюмосилікати натрію і кальцію. Використовування молекулярних сит дозволяє розділяти суміші речовин за розмірами їх молекул і гнучко управляти процесом адсорбції. Зміна умов приготування цеолітів дозволяє регулювати їх поглинювальну здатність і селективність і використовувати як іонообмінні смоли. Іоніти, так само як і адсорбенти, для ефективного процесу обміну повинні володіти максимальною поверхнею контакту з розчином. Розрізняють природні і штучні іоніти. Природні іоніти (глини, апатити, вугілля, целюлоза і т.д.) нестійкі в лугах і кислотах, що істотно обмежує їх застосування. Штучні іоніти (плавлені цеоліти, гідроксиди заліза і алюмінію, а особливо синтетичні смоли) дозволили значно розширити область застосування іонного обміну. Синтетичні смоли, використовувані для виготовлення іонітів, найчастіше представляють собою решітку (матрицю), в якій знаходяться функціональні активні групи (іони), що визначають властивості іонітів. По знаках зарядів, що належать активним групам, розрізняють: катіоніти (марка — К) і аніоніти (марка — А). Смоли, що містять декілька функціональних активних груп різної природи, називають поліфункціональними (поліамфолітами). Суха іонообмінна смола стає іонітом тільки після набухання її у воді, коли після дисоціації іоногенних груп з'являються рухомі іони.
Лекція 12
АПАРАТИ ДЛЯ ПРОВЕДЕННЯ АДСОРБЦІЇ Процеси адсорбції проводяться в основному наступними способами: з нерухомим шаром адсорбенту; з рухомим шаром адсорбенту; з псевдозрідженим шаром адсорбенту.
12.1 Апарати з нерухомим шаром адсорбенту Найчастіше такий апарат є вертикально встановленою циліндровою ємністю 1, заповнену адсорбентом, що подається через штуцер 8 і вивантажуваним після закінчення терміну служби через люки 2 (рис. 12.1). Такі апарати працюють періодично, причому повний цикл їх роботи зводиться звичайно до чотирьох стадій. 1. Власне адсорбція — насичення поглинача компонентом, що адсорбується. Початкова суміш подається через штуцер 7 і відводиться через патрубок 3. 2. Десорбція — виділення поглиненого компоненту з адсорбенту, здійснюване шляхом подачі через патрубок 5 регенеруючої пари. Відведення пари при десорбції і конденсату здійснюється через штуцер 6 і патрубок 4. 3. Сушка адсорбенту — видалення залишку конденсату (що утворився на стадії десорбції за рахунок дії регенеруючої пари) з адсорбенту гарячим повітрям, що подається через штуцер 7. 4. Охолоджування адсорбенту — оскільки активність адсорбенту підвищується із зменшенням його температури, після сушки він обробляється холодним повітрям, яке також подається через штуцер 7. Включення в технологічну схему декількох адсорберів з нерухомим шаром адсорбенту дозволяє створювати умови його безперервної роботи. При цьому в одному апараті здійснюється стадія адсорбції, а в іншому (інших) — стадії десорбції і регенерації адсорбенту. До недоліків таких апаратів і схем відноситься складність управління. Крім того, необхідність частих перемикань, пропарювань, сушок і охолоджувань адсорбенту викликає неминучі втрати матеріалів, непропорційну витрату водяної пари і повітря, велика вірогідність виникнення каналів в шарі адсорбенту.
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 605; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.83.202 (0.013 с.) |

 (10.4)
(10.4)

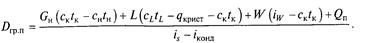 (10.6)
(10.6)


 (11.2)
(11.2)



