
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фазові рівноваги в двокомпонентних системах. Закон Рауля.Содержание книги
Поиск на нашем сайте
ЗАВДАННЯ №3 Типи розчинів. Розчинність. У теоретичних і практичних дослідженнях користуються двома теоріями розчинів: 1) Фізична теорія розчинів – ґрунтується на вивченні різних характеристик розчинів. 2) Хімічна теорія розчинів (розроблена Мендилеевим) згідно цієї теорія при розчинені відбувається хімічна взаємодія, що супроводжується утворенням соловатів. Процес утворення розчинів можна розглядати з позицій виконання двох умов: 1 – Термодинамічних, і 2- кінетичних. Розчинність – максимальна кількість грамів(молів), яка може бути розчинена у 100г розчинника при певній Т. Існують декілька способів розподілу розчинів на типи: - Тверді розчини(сплави) - Рідинні - Газоподібні Розчини також розрізняються за здатністю компонентів змішуватися: - Розчинена речовина і розчинник змішується не обмежено. - Розчинена речовина і розчинник змішується обмежено. - Розчинена речовина і розчинник не змішується. Розчинність залежить від багатьох фактів, але експериментально встановлено певну закономірність: подібне добре розчиняється в подібному.
Фазові рівноваги в двокомпонентних системах. Закон Рауля. Нехай маємо розчин що складається з двох речовин А і В які добре розчиняються один в одному. Над рідинною фазою існує газоподібна яка містить тіж самі компоненти що і рідина. Через деякий час після розчинення на поверхні встановлюється рівновага між рідиною і газоподібною фазою. При цьому склад обох фаз неоднаковий умовою рівноваги у таких гетерогенних системах є рівність хімічних потенціалів у рідинній та газоподібних фазах.
Закон Рауля: «Парціальний тиск пари данного компонента пропорційний його молярній частці у суміші.» Висновок з закону Рауля: «При постійній Т відносне зниження тисків пари чистого розчинника над розчином дорівнює молярній частці розчиненої речовини.» Закон Рауля для реальних розчинів. З точки зору будови реальних систем та характеристик між молекулярної взаємодії для ідеальної моделі реального розчину: 1) Відсутність теплового ефекту реакції та будь-яких змін об’єму в процесі проходження реакції. 2) Рівність сил між молекулярної взаємодії між будь-якими молекулами що входять до складу системи
Закони Коновалова. Перший закон Коновалова: «Насичена пара порівняно з рівноважним розчином збагачена тим компонентом, додавання якого до розчину підвищує тиск насиченої пари над розчином або знижує Т кип.» Другий закон Коновалова: «У точках максимуму та мінімуму на кривих загального тиску і Ткипсклад пари і рівноважного з нею розчину однаковий.» Третій закон Коновалова: «При постійній Т або р зміна складу розчину і насиченої пари проходить в одному напрямку(симбатно).» Закони Коновалова відіграють важливу роль при побудові діаграм фазової рівноваги, за допомогою яких можна теоретично обґрунтувати процес фракційної перегонки.
Властивості розчинів твердих речовин у рідинах. Основну теорію розчину твердих тіл у рідині складає положення: «Тиск пари над чистим розчинником завжди більше ніж тиск пари над розчином.» З точки зору теорії міжмолекулярної взаємодії це пояснюється: «Наявність твердих речовин в розчині знижує кількість молекул розчинника в одиниці об’єму. Що в свою чергу знижує кількість молекул, які можуть перейти з рідкої в газоподібну фазу. Використовуючи закон Рауля можна записати що молярна частка твердих розчинників речовини
Також те,що зниження Тзм, порівняно з Тзм чистого розчинника, пропорційна його моляльній концентрації m.
Термодинамічна активність. Термодинамічна активність а компонента розчину – це така фізична ТД величина, підставивши яку в формулу хімічного потенціалу замість концентрації робить її справедливою для реального розчину. Математичний запис:
Щодо розрахунків та аналізу результатів експерименту поряд з активністю використовують поняття коефіцієнта активності, математичний запис якого:
Середня активність електроліту:
Швидкість хімічної реакції Швидкістю хімічної реакції и називають зміну концентрації будь-якої речовини, яка бере участь у реакції, за одиницю часу: Як правило, швидкість реакції обчислюють за концентраціями вихідних речовин і тому похідна dс/d? від'ємна, оскільки концентрації цих речовин з часом зменшуються. Тому в правій частині рівняння (3.1) стоїть знак мінус. Швидкість реакції завжди додатна. В основі одпостадійних реакцій лежить закон дії мас (закон Гульдберга і Вааге), згідно з яким швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин. Причому кожну з концентрацій беруть у ступені, що дорівнює стехіометричному коефіцієнту, який стоїть перед формулою даної сполуки в реакції (n1 n2, n3,....0) Коефіцієнт пропорційності К для даної реакції при сталій температурі є величиною сталою, його називають константою швидкості реакції, оскільки вона не залежить від концентрації реагуючих речовин і часу. Із рівняння випливає, що при С] = С2 = С3 = 1 швидкість реакції чисельно дорівнює константі швидкості, яку іноді називають питомою швидкістю реакції. Відносно кінетики хімічні реакції поділяють за ознакою молекулярності та порядку реакції. За кількістю молекул, що беруть участь в елементарному хімічному акті, визначають молекулярність реакції Молекулярність реакції завжди є цілим додатним числом: 1, 2, рідко 3. За цією ознакою розрізняють моно-, бі-, тримолекулярні реакції. Реакції вищої молекулярності па практиці не трапляються. Це пояснюється тим, що вірогідність одночасного зіткнення чотирьох і більше молекул дуже мала. У більшості випадків за рівнянням реакції неможливо дійти висновку про її молекулярність, оскільки воно не відбиває наявності проміжних стадій. Багатостадійність реакції не дає можливості вивчити кінетику процесу взагалі. З огляду на це кінетичні реакції зручніше характеризувати не молекулярністю, а порядком. Порядок реакції визначається за рівнянням, яке виражає залежність швидкості реакції від концентрації реагуючих речовин і дорівнює сумі показників ступенів концентрацій. У багатостадійних реакціях загальна швидкість процесу визначається стадією з найбільш малою константою швидкості. Таку стадію називають лімітуючою. Сукупність усіх стадій, з яких складається процес перетворення вихідних речовин у продукти реакції, називають механізмом хімічної реакції. Для складних реакцій молекулярність і порядок, як правило, не збігаються. Отже, порядок реакції характеризує формальну кінетичну залежність швидкості реакції від концентрації реагуючих речовин, а молекулярність — елементарний механізм окремої стадії складного процесу. Ці поняття збігаються тільки для простих за механізмом реакцій. З підвищенням температури швидкість хімічної реакції, як правило, зростає. Для приблизної оцінки вилину температури на швидкість реакції для невеликого інтервалу низьких температур можна використовувати правило Вант-Гоффа, згідно з яким підвищення температури па 10°С збільшує швидкість хімічної реакції у 2—4 рази: Розглянемо фізичний зміст поняття «енергія активації». Згідно з теорією Арреніуса хімічна взаємодія відбувається лише при зіткненні частинок з достатньо високим рівнем кінетичної енергії. Такі молекули (частинки) називають активними, або реакційноздатними. Щоб молекули могли вступити у хімічну взаємодію, вони повинні мати певний надлишок енергії порівняно з її середнім значенням. Цей мінімальний надлишок енергії у перерахунку на один моль речовини називається енергією активації Е. Паралельні реакції У випадку паралельних реакцій одні і тіж самі речовини реагують одночасно у декількох напрямках утворюючи різні продукти. Приклад: необоротна реакція першого порядку: Загальна швидкість реакції Для одержання окремих к1к2запишемо рівняння для швидкостей В і С
Відомо Тобто у будь-який момент реакції співвідношень будь-яких відношень реакцій є сталою величиною яка дорівнює відношенню констант швидкостей паралельних реакцій Послідовні реакції Більшість хімічних реакцій має складний механізм і вони перебігають через ряд послідовних стадій, а кінцеві продукти утворення з нестійких проміжних продуктів (молекул, атомів) у зв`язку з цим досліди цих послідовних реакцій –важлива задача хімічної кінетики. Найбільш простим прикладом для розгляду є випадок двох послідовних необоротних реакцій першого порядку
У початковий момент часу t=0 кінцева речовина. Речовина А=а, речовини В та С відсутні. Через деякий час t концентрація речовин становитимуть:
Швидкість перетворення речовини А в В Швидкість перетворення речовини Вв С Залежність концентрацій кінцевого продукту у вигляді Час досягнення максимуму Максимальна концентрація проміжного продукту
Теорія активних зіткнень. Теорія активних зіткнень ґрунтується на використанні результатів, отриманих у кінетичній теорії газів. Згідно цієї теорії, число подвійних зіткнень: µ - зведена маса молекул σA(B)- діаметр молекули А(В) nA(B)- концентрація Швидкість реакції А+В=D+F: Константа швидкості реакції другого порядку Е0 – істинна енергія активації: За допомогою теорії активних зіткнень неможливо теоретично обчислити енергію активації Еа.. Стеричний множник – множник Р, який враховує необхідну орієнтацію молекул реагентів при зіткненні(
ЗАВДАННЯ №3 Типи розчинів. Розчинність. У теоретичних і практичних дослідженнях користуються двома теоріями розчинів: 1) Фізична теорія розчинів – ґрунтується на вивченні різних характеристик розчинів. 2) Хімічна теорія розчинів (розроблена Мендилеевим) згідно цієї теорія при розчинені відбувається хімічна взаємодія, що супроводжується утворенням соловатів. Процес утворення розчинів можна розглядати з позицій виконання двох умов: 1 – Термодинамічних, і 2- кінетичних. Розчинність – максимальна кількість грамів(молів), яка може бути розчинена у 100г розчинника при певній Т. Існують декілька способів розподілу розчинів на типи: - Тверді розчини(сплави) - Рідинні - Газоподібні Розчини також розрізняються за здатністю компонентів змішуватися: - Розчинена речовина і розчинник змішується не обмежено. - Розчинена речовина і розчинник змішується обмежено. - Розчинена речовина і розчинник не змішується. Розчинність залежить від багатьох фактів, але експериментально встановлено певну закономірність: подібне добре розчиняється в подібному.
Фазові рівноваги в двокомпонентних системах. Закон Рауля. Нехай маємо розчин що складається з двох речовин А і В які добре розчиняються один в одному. Над рідинною фазою існує газоподібна яка містить тіж самі компоненти що і рідина. Через деякий час після розчинення на поверхні встановлюється рівновага між рідиною і газоподібною фазою. При цьому склад обох фаз неоднаковий умовою рівноваги у таких гетерогенних системах є рівність хімічних потенціалів у рідинній та газоподібних фазах.
Закон Рауля: «Парціальний тиск пари данного компонента пропорційний його молярній частці у суміші.» Висновок з закону Рауля: «При постійній Т відносне зниження тисків пари чистого розчинника над розчином дорівнює молярній частці розчиненої речовини.»
|
||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 402; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.198 (0.009 с.) |

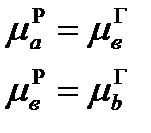 Або після деяких хімічних перетворювань:
Або після деяких хімічних перетворювань: 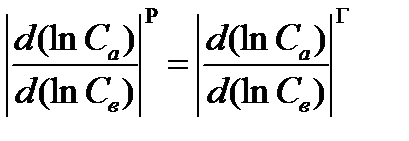
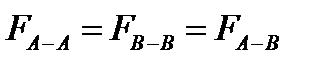
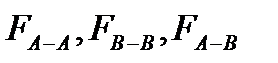 сили між молекулярної взаємодії між молекулами розчинника, домішки і між молекулами розчинника і домішки.
сили між молекулярної взаємодії між молекулами розчинника, домішки і між молекулами розчинника і домішки.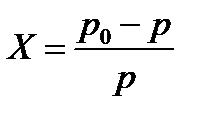 Ще з закону Рауля слідує, що Ткип такого розчину вище за Ткип чистого розчинника.
Ще з закону Рауля слідує, що Ткип такого розчину вище за Ткип чистого розчинника.
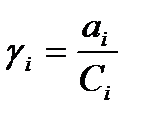
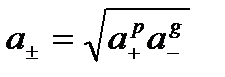


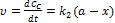
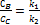


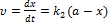
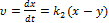
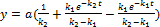
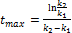
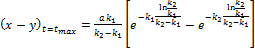


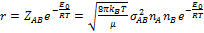
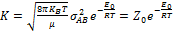
 RT
RT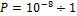 )
)


