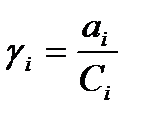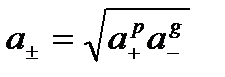Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон Рауля для реальних розчинів.Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
З точки зору будови реальних систем та характеристик між молекулярної взаємодії для ідеальної моделі реального розчину: 1) Відсутність теплового ефекту реакції та будь-яких змін об’єму в процесі проходження реакції. 2) Рівність сил між молекулярної взаємодії між будь-якими молекулами що входять до складу системи
Закони Коновалова. Перший закон Коновалова: «Насичена пара порівняно з рівноважним розчином збагачена тим компонентом, додавання якого до розчину підвищує тиск насиченої пари над розчином або знижує Т кип.» Другий закон Коновалова: «У точках максимуму та мінімуму на кривих загального тиску і Ткипсклад пари і рівноважного з нею розчину однаковий.» Третій закон Коновалова: «При постійній Т або р зміна складу розчину і насиченої пари проходить в одному напрямку(симбатно).» Закони Коновалова відіграють важливу роль при побудові діаграм фазової рівноваги, за допомогою яких можна теоретично обґрунтувати процес фракційної перегонки.
Властивості розчинів твердих речовин у рідинах. Основну теорію розчину твердих тіл у рідині складає положення: «Тиск пари над чистим розчинником завжди більше ніж тиск пари над розчином.» З точки зору теорії міжмолекулярної взаємодії це пояснюється: «Наявність твердих речовин в розчині знижує кількість молекул розчинника в одиниці об’єму. Що в свою чергу знижує кількість молекул, які можуть перейти з рідкої в газоподібну фазу. Використовуючи закон Рауля можна записати що молярна частка твердих розчинників речовини
Також те,що зниження Тзм, порівняно з Тзм чистого розчинника, пропорційна його моляльній концентрації m.
Закон розподілу. Екстракція. Осмотичний тиск. Розглянемо систему з двох рідин, що не змішуються між собою. Введемо в цю систему 3 компонент, як показує експеримент через деякий час у системі спостерігається певна рівновага. Цей стан описує закон Нернста-Шилова: «Відношення концентрації третього компонента в обох фазах при фіксованії Т є величиною сталою.»
Закон розподілу Нернста-Шилова – теоретична основа процесу екстракції. Екстракція – процес виділення речовини з розчину, за допомогою розчинника, який незмішуеться з розчином, але розчинена речовина в екстрагенті розчиняється краще. Додатковий тиск розчинника завдяки якому прогинається мембрана отримав назву осмотичний тиск, який підкорюється закону Вант-Гоффа: «Осматичний тиск розбавлених розчинів прямо пропорційний концентрації і Т.»
Розчини які мають однаковий осмотичний тиск називається ізотонічні( Електроліти. Основні положення теорії Арреніуса. Електроліти - це речовини, розчини та розплави яких, здатні проводити електричний струм. Електропровідність електролітів зумовлена наявністю в середовищі заряджених частинок – їонів, які є носіями електричного струму. Основною ідеєю торії аналітичної дисоціації Арреніуса можна сформулювати так: «При утворенні розчину електроліту відбувається дисоціація розчиняємої речовини.» Ступень дисоціації можна визначити дослідним шляхом при вивченні різноманітних властивостей розчинів: - Тиску насиченої пари. - Осмотичному тиску - Ткип і кристалізації. - Тощо. Подібне вивчення ступені дисоціації дало можливість поділити всі відомі електроліти на 2 групи сильні та слабкі. Для розчинів слабких електролітів які дисоціюють на однозарядні їони константа дисоціації записується у вигляді:
Термодинамічна активність. Термодинамічна активність а компонента розчину – це така фізична ТД величина, підставивши яку в формулу хімічного потенціалу замість концентрації робить її справедливою для реального розчину. Математичний запис:
Щодо розрахунків та аналізу результатів експерименту поряд з активністю використовують поняття коефіцієнта активності, математичний запис якого:
Середня активність електроліту:
|
||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 422; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.235.100 (0.007 с.) |

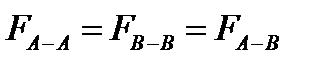
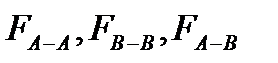 сили між молекулярної взаємодії між молекулами розчинника, домішки і між молекулами розчинника і домішки.
сили між молекулярної взаємодії між молекулами розчинника, домішки і між молекулами розчинника і домішки.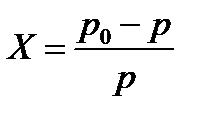 Ще з закону Рауля слідує, що Ткип такого розчину вище за Ткип чистого розчинника.
Ще з закону Рауля слідує, що Ткип такого розчину вище за Ткип чистого розчинника. C1,C2 – концентрації третього компонента у 1 і 2 фазах.
C1,C2 – концентрації третього компонента у 1 і 2 фазах.
 1=
1=  2).
2). Цей вираз представляє собою математичний запис закону розбавлення Освальда.
Цей вираз представляє собою математичний запис закону розбавлення Освальда.